题目内容
【题目】氢气是一种清洁能源。制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。
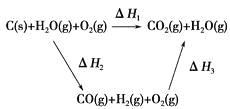
(1)已知; ![]() (g)+H2(g)→
(g)+H2(g)→![]() (g) H=-119.6kJ/mol
(g) H=-119.6kJ/mol
![]() (g)+2H2(g)→
(g)+2H2(g)→![]() (g) H=-237.1kJ/mol
(g) H=-237.1kJ/mol
![]() (g)+3H2(g)→
(g)+3H2(g)→![]() (g) H=-208.4kJ/mol
(g) H=-208.4kJ/mol
请求出![]() (g)+H2(g)→
(g)+H2(g)→![]() (g) H=________kJ/mol
(g) H=________kJ/mol
(2)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。
![]() (g)
(g)![]()
![]() (g)+3H2(g)
(g)+3H2(g)
在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=_______(用含a、b的关系式表达)。
(3)一定条件下,如下图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其它有机物生成)。
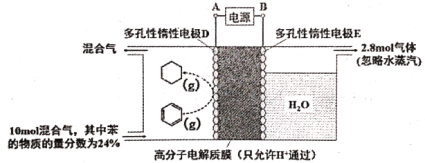
①实现有机物储氢的电极是__________;A 正极 B 负极 C 阴极 D 阳极
其电极反应方程为:___________。
②实验研究表明,当外加电压超过一定值以后,发现电极D产物中苯(g)的体积分数随着电压的增大而减小,其主要原因是相关电极除目标产物外,还有一种单质气体生成,这种气体是__________。已知单质气体为2 mol,求此装置的电流效率η=__________。[η=(生成目标产物消耗的电子数/转移的电子总数)×100%,计算结果保留小数点后1位]。
【答案】-117.5 27b4/a-b C C6H6+6H++6e- =C6H12 H2 64.3%
【解析】
(1)根据已知焓变的热化学方程式推导所求反应,再由盖斯定律计算所求反应的焓变;
(2)根据方程式计算各组分的平衡浓度,代入平衡常数表达式计算;
(3)①活泼的氢发生氧化反应,是负极,与负极相连的是阴极,
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷;阳极上生成氧气,同时生成氢离子,阴极上苯得电子和氢离子反应生成环己烷,苯参加反应需要电子的物质的量与总转移电子的物质的量之比就是电流效率η。
(1)已知:①![]() (g)+H2(g)→
(g)+H2(g)→![]() (g) H1=-119.6kJ/mol
(g) H1=-119.6kJ/mol
②![]() (g)+2H2(g)→
(g)+2H2(g)→![]() (g) H2=-237.1kJ/mol
(g) H2=-237.1kJ/mol
③![]() (g)+3H2(g)→
(g)+3H2(g)→![]() (g) H3=-208.4kJ/mol
(g) H3=-208.4kJ/mol
所求反应为:![]() (g)+H2(g)→
(g)+H2(g)→![]() (g),该反应可由②①得到,根据盖斯定律,该反应的焓变为H=H2H1=117.5kJ/mol,故答案为:117.5;
(g),该反应可由②①得到,根据盖斯定律,该反应的焓变为H=H2H1=117.5kJ/mol,故答案为:117.5;
(2)由![]() (g)
(g)![]()
![]() (g)+3H2(g),环已烷起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,则平衡时c(环己烷)=(ab)mol/L,c(H2)=3bmol/L,所以K=
(g)+3H2(g),环已烷起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,则平衡时c(环己烷)=(ab)mol/L,c(H2)=3bmol/L,所以K=![]() =
=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(3)①活泼的氢发生氧化反应,是负极,该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e- =C6H12,故答案为:C;C6H6+6H++6e- =C6H12;
②阳极上氢氧根离子放电生成氧气,阳极上生成2.8mol氧气转移电子的物质的量=2.8mol×4=11.2mol,生成1mol氧气时生成2mol氢气,则生成2.8mol氧气时同时生成5.6mol氢气;
设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×24%xmol,反应后苯的含量=![]() =10%,x=1.2,苯转化为环己烷转移电子的物质的量为1.2mol×6=7.2mol,则
=10%,x=1.2,苯转化为环己烷转移电子的物质的量为1.2mol×6=7.2mol,则![]() ×100%=64.3%,故答案为:H2;64.3%。
×100%=64.3%,故答案为:H2;64.3%。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案