题目内容
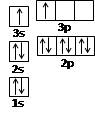
A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D、E是第四周期元素,其中E元素的核电荷数为29。D原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为 ,1mol该分子中含有 键的数目为 。
键的数目为 。
(3)基态D原子的外围电子排布式为 。DO2Cl2熔点:-96 .5℃,沸点:117℃,则固态DO2Cl2属于 晶体。
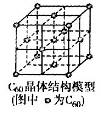
(4)E的氢化物的晶胞结构如图所示,其化学式是 。

(1)A、B、C的第一电离能由小到大的顺序为 。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为 ,1mol该分子中含有
 键的数目为 。
键的数目为 。(3)基态D原子的外围电子排布式为 。DO2Cl2熔点:-96 .5℃,沸点:117℃,则固态DO2Cl2属于 晶体。
(4)E的氢化物的晶胞结构如图所示,其化学式是 。

(12分)
A:(1)C<O<N(2分)
(2)N≡C-C≡N (2分) 4NA(或2.408×1024)(2分)
(3)3d54s1(2分) 分子(2分)
(4)CuH(2分)
A:(1)C<O<N(2分)
(2)N≡C-C≡N (2分) 4NA(或2.408×1024)(2分)
(3)3d54s1(2分) 分子(2分)
(4)CuH(2分)
试题分析:A为C、B为N,C为O,D是Cr,E为Cu,⑴同一周期第一电离能由小变大,其中N的2P轨道是半满状态,第一电离能变大,答案:C<O<N;CN―与N2为等电子体,C与N之间形成叁键,结构式为N≡C-C≡N,其中每个分子
 键的数目为4个,答案:N≡C-C≡N 、 4NA(或2.408×1024);⑶注是要求写D原子的外围电子排布式3d54s1,DO2Cl2熔点、沸点低,符合分子晶体的性质,答案:3d54s1、 分子;⑷由图晶胞中Cu为8×1/8+6×1/2=4,H为4,是离子化合物,化学式为CuH,答案:CuH。
键的数目为4个,答案:N≡C-C≡N 、 4NA(或2.408×1024);⑶注是要求写D原子的外围电子排布式3d54s1,DO2Cl2熔点、沸点低,符合分子晶体的性质,答案:3d54s1、 分子;⑷由图晶胞中Cu为8×1/8+6×1/2=4,H为4,是离子化合物,化学式为CuH,答案:CuH。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


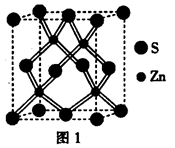
 ,平面结构)属于________(填“极性”或“非极性”)分子。
,平面结构)属于________(填“极性”或“非极性”)分子。



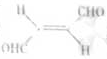 ,下列叙述正确的有 ⑤ 。
,下列叙述正确的有 ⑤ 。 键和1个
键和1个 键
键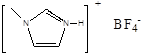 的熔点(填>、<或=),其原因是 ⑦
的熔点(填>、<或=),其原因是 ⑦