题目内容
已知A、B、C、D均是元素周期表中前36号中的元素,其原于序数依次递增,其他相关结构或性质信息如下表。
请根据信息回答有关问题:
(1)C元素在周期表中的位置为____ ,D元素原子的外围电子排布式为
(2)用氢键表示式写出A的氢化物水溶液中存在的所有氢键____ 。
(3)A与氧可形成原子个数比为2:1的三原子分子,其中氧的化合价为____ ,氧原子杂化类型与下列分子的中心原子杂化类型相同的是____
a:CO2 b:SO2 c:NH3 d;CH4
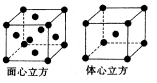
(4)A、B可形成离子化合物,其晶胞结构如下图甲所示,则晶胞中B离子的个数为____ ,与B离子最近且等距的A离子的个数为 。
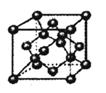
(5)1183 K以下C晶体的晶胞如图乙中图1,而1183 K以上则转变为图2,在两种晶胞中最邻近的C原子间距离相同,则图1、图2所示两种晶中原子的空间利用率之比为___ _(可用根号表示)。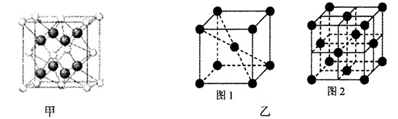
| 元素 | 结构或性质信息 |
| A | 原子核外有一个未成对电子,其氢化物与水分子间能形成氢键 |
| B | 原子核外M层电子数是N层电子数的4倍 |
| C | 是使用最为广泛的合金的主要成分 |
| D | 原子各内层电子均已饱和,最外层电子数为1 |
请根据信息回答有关问题:
(1)C元素在周期表中的位置为____ ,D元素原子的外围电子排布式为
(2)用氢键表示式写出A的氢化物水溶液中存在的所有氢键____ 。
(3)A与氧可形成原子个数比为2:1的三原子分子,其中氧的化合价为____ ,氧原子杂化类型与下列分子的中心原子杂化类型相同的是____
a:CO2 b:SO2 c:NH3 d;CH4
(4)A、B可形成离子化合物,其晶胞结构如下图甲所示,则晶胞中B离子的个数为____ ,与B离子最近且等距的A离子的个数为 。
(5)1183 K以下C晶体的晶胞如图乙中图1,而1183 K以上则转变为图2,在两种晶胞中最邻近的C原子间距离相同,则图1、图2所示两种晶中原子的空间利用率之比为___ _(可用根号表示)。

(1)第四周期Ⅷ族(1分) 3d104s1(2分)
(2)F—H…F、F—H…O、O—H…F、O—H…O(4分或其他正确表示)
(3)+2(1分)cd(2分)
(4)4(1分) 8(1分)
(5) 或0.92:1或68%:74%等合理答案均给分(3分)
或0.92:1或68%:74%等合理答案均给分(3分)
(2)F—H…F、F—H…O、O—H…F、O—H…O(4分或其他正确表示)
(3)+2(1分)cd(2分)
(4)4(1分) 8(1分)
(5)
 或0.92:1或68%:74%等合理答案均给分(3分)
或0.92:1或68%:74%等合理答案均给分(3分)试题分析:原子核外有一个未成对电子,其氢化物与水分子间能形成氢键,因此A是F元素;原子核外M层电子数是N层电子数的4倍,这说明M是20号元素Ca;C是使用最为广泛的合金的主要成分,因此C是铁元素;原子各内层电子均已饱和,最外层电子数为1,则D是29号元素Cu。
(1)铁元素在周期表中的位置为第四周期Ⅷ族;铜元素原子的外围电子排布式为3d104s1。
(2)F和O都是活泼的非金属,能形成氢键,所以A的氢化物水溶液中存在的所有氢键为F—H…F、F—H…O、O—H…F、O—H…O。
(3)F的非金属性强于氧元素,在化合物中F只有-1价,所以如果A与氧可形成原子个数比为2:1的三原子分子,则其中氧的化合价为+2价。在该分子中氧元素含有的孤对电子对数=(6-2×1)÷2=2,因此 该分子是V形结构,氧元素是sp3杂化。CO2、SO2、NH3、CH4分子中中心原子的杂化轨道类型分别是sp、sp2、sp3、sp3,所以答案选cd。
(4)A、B形成离子化合物是CaF2,则根据晶胞结构可知,晶胞中B离子的个数为=8×
 +6×
+6×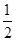 =4个;与B离子最近且等距的A离子的个数为8个。
=4个;与B离子最近且等距的A离子的个数为8个。(5)设铁原子半径是r,立方体边长图1是a,图2是b,则根据图1可知a2+2a2=(4r)2,解得a=
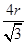 ,所以图1中铁原子的空间利用率是
,所以图1中铁原子的空间利用率是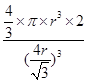 。根据图2可知b2+b2=(4r)2,解得b=
。根据图2可知b2+b2=(4r)2,解得b= ,所以图2中铁原子的空间利用率是
,所以图2中铁原子的空间利用率是 ,所以铁原子的空间利用率之比为
,所以铁原子的空间利用率之比为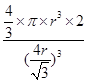 :
: =
= 。
。
练习册系列答案
相关题目



 键的数目为 。
键的数目为 。