题目内容
【题目】下列过程需要加还原剂实现的是( )
A. Fe2+→Fe3+ B. H2O2→ O2 C. Cl2 →2Cl- D. CO2 →CO32-
【答案】C
【解析】
当物质所含元素化合价降低时,被还原,须加入还原剂才能实现,以此解答本题。
A.Fe2+→Fe3+的反应中Fe的化合价升高,需加入氧化剂才能实现,故A不选;
B.H2O2→O2的反应中氧元素化合价升高,需加入氧化剂或发生自身的分解反应,故B不选;
C.Cl2→2Cl-的反应中Cl元素的化合价降低,被还原,须加入还原剂才能实现,故C选;
D.CO2→CO32-反应中所含元素化合价没有发生变化,不需要加入氧化剂,故D不选。
故答案选C。

 优学名师名题系列答案
优学名师名题系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t/°C | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是(____)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_______℃。
【题目】炼锌厂产生的工业废渣——锌渣(除了含Zn 外,还含有Fe、Al、Cd (镉)和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O 和金属镉(Cd)是一个有益的尝试,流程如下:
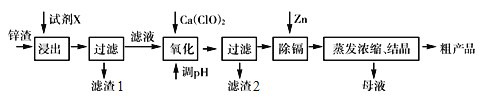
已知:金属活动性Zn> Cd
物质 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Cd(OH)2 | Fe(OH)2 |
完全沉淀时的PH | ≥3.2 | ≥4.7 | ≥6.5 | ≥9.4 | ≥9.7 |
试回答下列问题:
(1)第一步浸出时用到的试剂X为__________,滤渣1的成分是___________。
(2)加入Ca(ClO)2 的目的是氧化Fe2+,写出反应的离子方程式____________________。
(3)调节pH 过程可以选用;本流程的pH 调节一般调至5,其目的是_____________________。
(4)写出过滤后加入过量的锌粉反应的离子方程式__________________。
(5)在蒸发浓缩操作时,要保持一定的酸度,其目的是______。

