题目内容
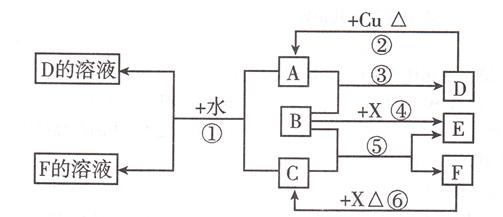
A、B、C、D、E是中学常见的几种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。

回答下列问题:
(1)X的单质与A反应的化学方程式是________________________________。
(2)若C溶液显碱性,则试剂1是 ____溶液(写化学式);若C溶液显酸性,则显酸性的原因是(用离子方程式表示) 。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是 ;
②写出D→E反应的离子方程式 ;
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是: 。

回答下列问题:
(1)X的单质与A反应的化学方程式是________________________________。
(2)若C溶液显碱性,则试剂1是 ____溶液(写化学式);若C溶液显酸性,则显酸性的原因是(用离子方程式表示) 。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是 ;
②写出D→E反应的离子方程式 ;
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是: 。
(1)2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
(2)NaOH(或OH-) Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
(3)①取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色;则证明原溶液含有Fe3+
②2Fe3++Fe=3Fe2+ ③2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
 2Fe+Al2O3
2Fe+Al2O3(2)NaOH(或OH-) Al3++3H2O
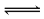 Al(OH)3+3H+
Al(OH)3+3H+(3)①取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色;则证明原溶液含有Fe3+
②2Fe3++Fe=3Fe2+ ③2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
试题分析:元素X、Y的单质是生活中常见的金属,Y的用量最大,则X为Al,Y为Fe,A、B是氧化物,则Al与氧化铁反应生成Fe和氧化铝;Al、氧化铝都既能与酸反应又能与碱反应,而Fe、氧化铁都能与酸反应,若C溶液显碱性,则试剂1为NaOH溶液时,C为偏铝酸钠;若C溶液为酸性,C为强酸对应的铝盐,试剂2为硫酸时,D为硫酸铁、E为硫酸亚铁;试剂1为硫酸时,C为硫酸铝,该溶液水解显酸性,
(1)X的单质与A反应为铝热反应,即Al与氧化铁反应生成氧化铝和Fe,该反应为Fe2O3+2Al

Al2O3+2Fe,
(2)若C溶液为碱性,试剂1是NaOH溶液,①Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;若C溶液显酸性,则显酸性的原因是Al3++3H2O
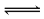 Al(OH)3+3H+
Al(OH)3+3H+(3)若试剂1和试剂2均是稀硫酸,
①D为硫酸铁,检验铁离子的方法为取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+,
故答案为:取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+;
②写出D→E反应的离子方程式2Fe3++Fe=3Fe2+;
③E为硫酸亚铁,与稀硫酸和亚硝酸钠为原料生成Fe(OH)SO4,反应中有NO生成,该反应为2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑,
故答案为:2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑.

练习册系列答案
相关题目