题目内容
(1)A元素的负一价离子和B元素的正一价离子的电子层结构都与氩相同,A的离子结构示意图为 ,B元素名称为 ;
(2)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素基态原子的外围电子排布式为 .
(3)D元素的原子序数为33,该元素原子的核外电子共有 种不同的运动状态,此元素原子的核外电子排布式是
(4)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的 键更稳定(填“σ”或“π”)。
(5)下列4种物质熔、沸点由高到低排列为 (填序号).
①金刚石 ②晶体锗 ③晶体硅 ④金刚砂
(2)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素基态原子的外围电子排布式为 .
(3)D元素的原子序数为33,该元素原子的核外电子共有 种不同的运动状态,此元素原子的核外电子排布式是
(4)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的 键更稳定(填“σ”或“π”)。
(5)下列4种物质熔、沸点由高到低排列为 (填序号).
①金刚石 ②晶体锗 ③晶体硅 ④金刚砂
(每空2分)(1)  ,钾;(2)3d104s1 (3) 33 ;【Ar】3d104s24p3
,钾;(2)3d104s1 (3) 33 ;【Ar】3d104s24p3
(4)π (5) ①>④>③>②
 ,钾;(2)3d104s1 (3) 33 ;【Ar】3d104s24p3
,钾;(2)3d104s1 (3) 33 ;【Ar】3d104s24p3(4)π (5) ①>④>③>②
试题分析:(1)A元素的负一价离子和B元素的正一价离子的电子层结构都与氩相同,则A和B分别是氯元素和钾元素,则A的离子结构示意图为
 。
。(2)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,所以C应该是铜元素,则根据构造原理可知,C的元素基态原子的外围电子排布式为3d104s1。
(3)D元素的原子序数为33,该元素原子的核外电子共有33种不同的运动状态。则根据构造原理可知,此元素原子的核外电子排布式是【Ar】3d104s24p3。
(4)氮气分子中的三键是由1个σ键和2个π键构成的,则π键键能是
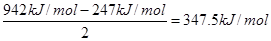 >247kJ/mol,所以π键比σ键稳定。
>247kJ/mol,所以π键比σ键稳定。(5)四种物质形成的晶体都是原子晶体,原子晶体中原子半径越小,共价键越强,晶体的熔沸点越高。由于原子半径是C<Si<Ge,所以4种物质熔、沸点由高到低排列为①>④>③>②。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,试题在注重对基础知识巩固和训练的同时,更侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。

练习册系列答案
相关题目