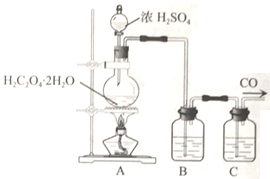
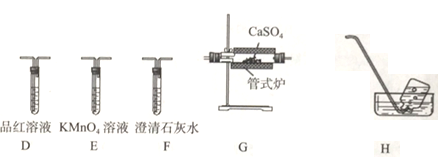
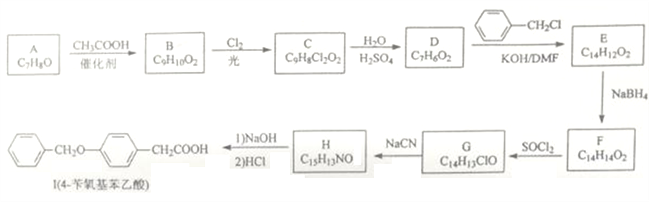
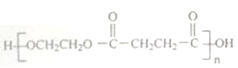题目内容
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)

(1)第①步中,操作A是________,第⑤步中,操作B是________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)______________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是__________。
(4)判断BaCl2已过量的方法是____________________________________。
(5)下列是某学生设计操作A后混合液中Cl-、SO42-的检验步骤请根据内容填空:
①首先检验_____离子,应先加入过量的_____________________。
②将所得混合物______(填操作名称),然后在溶液中加入试剂________检验另一离子。
【答案】溶解 过滤CaCl2+Na2CO3==CaCO3↓+2NaCl、BaCl2+Na2CO3==BaCO3↓+2NaCl操作③④中生成的Mg(OH)2、CaCO3、BaCO3沉淀会与盐酸反应生成可溶物质而无法过滤除去,从而影响精盐的纯度取第②步后的上层清液,滴入几滴BaCl2溶液,看是否有白色沉淀生成,若无沉淀生成,则表明BaCl2已过量SO42-Ba(NO3)2 HNO3过滤AgNO3(HNO3)
【解析】
(1)固体成分的检验,需要先溶解,即操作A为溶解;操作⑤得到滤液,应是过滤;(2)碳酸钠的作用是除去Ca2+和过量的Ba2+,发生的反应是CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl;(3)操作③④中生成的Mg(OH)2、CaCO3、BaCO3沉淀会与盐酸反应生成可溶物质而无法过滤除去,从而影响精盐的纯度;(4)取第②步后的上层清液,滴入几滴BaCl2溶液,看是否有白色沉淀生成,若无沉淀生成,则表明BaCl2已过量;(5)①检验Cl-一般用Ag+,检验SO42-一般用Ba2+,Ag2SO4微溶物,因此先检验SO42-,防止其他离子对实验的干扰,因此需要加入物质为Ba(NO3)2和HNO3,如果得到沉淀,说明含有SO42-;②将所得混合物进行过滤,然后向滤液中加入AgNO3和HNO3,如果有白色沉淀产生,则说明有Cl-存在。

 名校课堂系列答案
名校课堂系列答案【题目】根据要求回答下列有关问题。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=____________,温度升高后,K 值________(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=____________,温度升高后,K 值________(填“增大”、“不变”或“减小”)。
(2)已知:①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) H1= +489.0kJ/mol
②Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H2= -28.5kJ/mol
2Fe(s)+3CO2(g) H2= -28.5kJ/mol
③C(石墨)+ CO2(g) = 2CO(g) H3= akJ/mol ,
则a=__________kJ/mol。
(3)在T℃时,反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡时CO 的转化率为_______。
②下列情况标志反应达到平衡状态的是________(填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等