题目内容
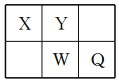
【题目】下列表格是元素周期表的一部分,请按要求填空
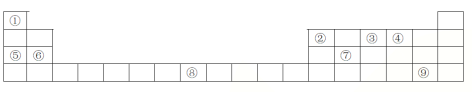
(1)元素①和⑤形成的化合物中存在的化学键类型为__________________
(2)写出由①②④形成的一种一元酸的分子式_________________
(3)写出由③形成的单质的电子式_________________
(4)列举元素⑦形成的氧化物一种用途________________;元素⑧在周期表中的位置 ____,
天津市有着丰富的海水资源,海水中元素⑤、⑥和⑨的含量很丰富,某化学兴趣小组先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。请回答下列问题
回答下列问题:
(5)海水淡化的方法主要是___________________________________(至少列举2种)
(6)采用“空气吹出法”从浓海水中吹出Br2,常温下,Br2的颜色为___________________。
吹出的溴用纯碱溶液吸收,吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+ NaHCO3(未配平),当吸收1mol Br2时,转移的电子数为________mol.
(7)从海水中获得元素⑤或⑥的化合物的一段工艺流程如图:
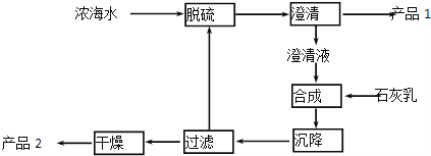
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,产品1的化学式为________________。产品2为Mg(OH)2。常温下向浓海水中滴加NaOH溶液,当Mg2+恰好完全沉淀时溶液的pH为_________。(已知25℃时Ksp[Mg(OH)2]=1.0×10-13)
(8)欲由MgCl2·6H2O加热制备MgCl2时,实验能取得成功的关键操作或条件是_________。
采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为______________
【答案】离子键H3BO3![]() 光导纤维、水晶饰品或制备硅等第四周期VIII族蒸馏法、离子交换膜法或电渗析法深红棕色5/3CaSO410在氯化氢气流保护下加热蒸干,或加入SOCl2后再加热蒸干MgCl2(熔融)
光导纤维、水晶饰品或制备硅等第四周期VIII族蒸馏法、离子交换膜法或电渗析法深红棕色5/3CaSO410在氯化氢气流保护下加热蒸干,或加入SOCl2后再加热蒸干MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
【解析】
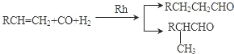
结合元素周期表分析,①为氢,②为硼,③为氮,④为氧,⑤为钠,⑥为镁,⑦为硅,⑧为铁,⑨为溴。
(1)氢和钠形成氢化钠,含有离子键。(2)氢和硼和氧形成硼酸,分子式为H3BO3 。 (3)氮气的电子式为:![]() 。(4)二氧化硅可以做光导纤维、水晶饰品或制备硅等。铁在第四周期VIII族。(5)海水淡化的方法有蒸馏法、离子交换膜法或电渗析法;(6)单质溴为深红棕色。在反应3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3中,3mol反应时转移5mol电子,故当吸收1mol溴时,转移的电子为 5/3 mol。(7)工艺流程合成步骤中加入石灰乳,镁离子和氢氧化钙反应生成氢氧化镁沉淀和钙离子,过滤干燥的产品2为氢氧化镁,滤液中的钙离子进行脱硫,用钙离子沉淀硫酸根离子生成硫酸钙沉淀,采用过滤的方法得到的产品1为硫酸钙。氢氧化镁完全沉淀后镁离子浓度小于10-5mol/L,已知25℃时Ksp[Mg(OH)2]= c2(OH-)c(Mg2+)=1.0×10-13,则计算c(OH-)=10-4mol/L,c(H+)=
。(4)二氧化硅可以做光导纤维、水晶饰品或制备硅等。铁在第四周期VIII族。(5)海水淡化的方法有蒸馏法、离子交换膜法或电渗析法;(6)单质溴为深红棕色。在反应3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3中,3mol反应时转移5mol电子,故当吸收1mol溴时,转移的电子为 5/3 mol。(7)工艺流程合成步骤中加入石灰乳,镁离子和氢氧化钙反应生成氢氧化镁沉淀和钙离子,过滤干燥的产品2为氢氧化镁,滤液中的钙离子进行脱硫,用钙离子沉淀硫酸根离子生成硫酸钙沉淀,采用过滤的方法得到的产品1为硫酸钙。氢氧化镁完全沉淀后镁离子浓度小于10-5mol/L,已知25℃时Ksp[Mg(OH)2]= c2(OH-)c(Mg2+)=1.0×10-13,则计算c(OH-)=10-4mol/L,c(H+)= ![]() =10-10mol/L,计算pH=10。但镁离子恰好完全沉淀时溶液的pH为10。 (8)氯化镁中的镁离子容易水解,在干燥的氯化氢气流中,抑制镁离子水解,且带走氯化镁晶体受热产生的水汽,或加入SOCl2后,其水解生成氯化氢和二氧化硫,抑制了镁离子水解,故能得到无水氯化镁,在不锈钢做阴极电解熔融氯化镁时,阳极产生氧化反应生成氯气,阴极室镁离子得到电子生成金属镁,电解方程式为 MgCl2(熔融)
=10-10mol/L,计算pH=10。但镁离子恰好完全沉淀时溶液的pH为10。 (8)氯化镁中的镁离子容易水解,在干燥的氯化氢气流中,抑制镁离子水解,且带走氯化镁晶体受热产生的水汽,或加入SOCl2后,其水解生成氯化氢和二氧化硫,抑制了镁离子水解,故能得到无水氯化镁,在不锈钢做阴极电解熔融氯化镁时,阳极产生氧化反应生成氯气,阴极室镁离子得到电子生成金属镁,电解方程式为 MgCl2(熔融) ![]() Mg+Cl2↑。
Mg+Cl2↑。