题目内容
【题目】一定质量的某有机物与足量金属钠反应,可得VAL气体。相同质量的该有机物与适量的碳酸钠浓溶液反应,可得VBL气体。已知在同温、同压下VA和VB不相同,则该有机物可能是( )
A.CH2=CHCOOH
B.HOOC—COOH
C.CH3CH2COOH
D.HOOCCH2CH(OH)CH2COOH
【答案】D
【解析】
有机物分子里的羟基和羧基都可以与金属钠反应放出氢气,但羧基与碳酸钠溶液反应放出二氧化碳气体;当有机物分子中只含羧基时,等质量的该有机物分别与钠和碳酸钠反应,放出的气体体积相同;当有机物分子中既含羧基又含羟基时, 羟基不能与碳酸钠反应,产生二氧化碳的体积应小于等质量的该有机物与钠反应产生氢气的体积;故选D。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】下列表格是元素周期表的一部分,请按要求填空
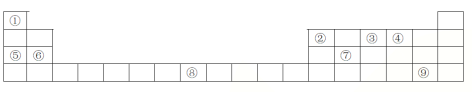
(1)元素①和⑤形成的化合物中存在的化学键类型为__________________
(2)写出由①②④形成的一种一元酸的分子式_________________
(3)写出由③形成的单质的电子式_________________
(4)列举元素⑦形成的氧化物一种用途________________;元素⑧在周期表中的位置 ____,
天津市有着丰富的海水资源,海水中元素⑤、⑥和⑨的含量很丰富,某化学兴趣小组先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。请回答下列问题
回答下列问题:
(5)海水淡化的方法主要是___________________________________(至少列举2种)
(6)采用“空气吹出法”从浓海水中吹出Br2,常温下,Br2的颜色为___________________。
吹出的溴用纯碱溶液吸收,吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+ NaHCO3(未配平),当吸收1mol Br2时,转移的电子数为________mol.
(7)从海水中获得元素⑤或⑥的化合物的一段工艺流程如图:
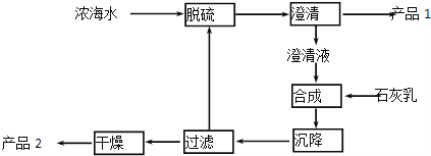
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,产品1的化学式为________________。产品2为Mg(OH)2。常温下向浓海水中滴加NaOH溶液,当Mg2+恰好完全沉淀时溶液的pH为_________。(已知25℃时Ksp[Mg(OH)2]=1.0×10-13)
(8)欲由MgCl2·6H2O加热制备MgCl2时,实验能取得成功的关键操作或条件是_________。
采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为______________
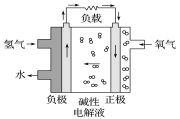
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |