题目内容
【题目】下列冶炼金属的原理正确的是
A. 电解食盐水制备金属钠 B. 电解氯化铝制备金属铝
C. 用MgO与CO热还原法制备单质镁 D. 加热分解Ag2O制备金属银
【答案】D
【解析】A.Na是活泼金属,如果电解饱和食盐水,阴极上氢离子放电生成氢气,得不到钠,应该电解熔融氯化钠冶炼,选项A错误;B、氯化铝是共价化合物不能导电,工业上是电解熔融的氧化铝制备铝,选项B错误;C、镁的还原性强于碳,不能用MgO与CO热还原法制备单质镁,选项C错误;D、金属活动顺序表中排在铜后面的金属氧化物不稳定受热分解产生金属单质,故加热分解Ag2O制备金属银,选项D正确。答案选D。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】制备苯甲酸的反应原理及有关数据如下:

名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 溶解度 |
甲苯 | 92 | 无色液体 | -95℃ | 110℃ | 不溶于水 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122℃ | 248℃ | 微溶于水 |
高锰酸钾 | 158 | 易溶于水 |
实验过程如下: ①将高锰酸钾、水和氢氧化钠溶液混合摇匀后,加入甲苯,采用电磁搅拌,加热(但温度不要太高),冷凝回流2h。如仍有高锰酸钾的紫色存在,则加数滴乙醇。 ②将混合液过滤后冷却。③滤液用盐酸酸化,析出白色晶体过滤,洗涤,干燥,得到苯甲酸的粗产品,最后测定其熔点。回答下列问题:
(1)①中反应易暴沸,本实验中采用______方法防止此现象;乙醇的作用是____________________。
(2)②中过滤出的沉淀是____________________。
(3)③中测定熔点时,发现到130℃ 时仍有少量不熔,推测此不熔物的成分是____________________。
(4)提纯苯甲酸粗产品的方法是____________________。
【题目】下列表格是元素周期表的一部分,请按要求填空
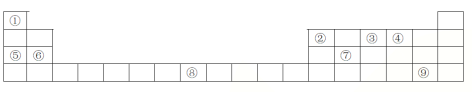
(1)元素①和⑤形成的化合物中存在的化学键类型为__________________
(2)写出由①②④形成的一种一元酸的分子式_________________
(3)写出由③形成的单质的电子式_________________
(4)列举元素⑦形成的氧化物一种用途________________;元素⑧在周期表中的位置 ____,
天津市有着丰富的海水资源,海水中元素⑤、⑥和⑨的含量很丰富,某化学兴趣小组先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。请回答下列问题
回答下列问题:
(5)海水淡化的方法主要是___________________________________(至少列举2种)
(6)采用“空气吹出法”从浓海水中吹出Br2,常温下,Br2的颜色为___________________。
吹出的溴用纯碱溶液吸收,吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+ NaHCO3(未配平),当吸收1mol Br2时,转移的电子数为________mol.
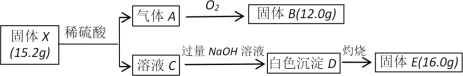
(7)从海水中获得元素⑤或⑥的化合物的一段工艺流程如图:
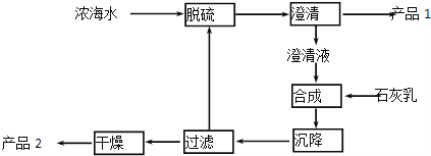
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,产品1的化学式为________________。产品2为Mg(OH)2。常温下向浓海水中滴加NaOH溶液,当Mg2+恰好完全沉淀时溶液的pH为_________。(已知25℃时Ksp[Mg(OH)2]=1.0×10-13)
(8)欲由MgCl2·6H2O加热制备MgCl2时,实验能取得成功的关键操作或条件是_________。
采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为______________