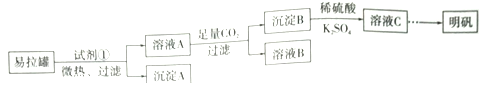
��Ŀ����
����Ŀ��X��Y��Z��Q��MΪ�����Ķ�����Ԫ�أ���ԭ���������������й���Ϣ�����
X | ��ֲ����������ȱ�ٵ�Ԫ�أ��ǵ����ʵ���Ҫ�ɷ� |
Y | �ؿ��к����ӵ�һλ |
Z | ����������ԭ�Ӱ뾶��� |
Q | �����д���ʹ����Ͻ���Ʒ����ҵ�Ͽ��õ����������ķ����Ʊ��䵥�� |
M | ��ˮ�д���������Ԫ��֮һ������������ϼ��븺�۵Ĵ�����Ϊ6 |
��1��X����̬�⻯��Ĵ���������������˵���������ʳ��������µļ������������⣬��д������̬�⻯��ĵ���ʽ ��
��2����֪37Rb��53I��λ�ڵ������ڣ��ֱ���Z��Mͬһ���壮�����й�˵����ȷ����������ţ���
A.ԭ�Ӱ뾶��Rb��I
B.RbM�к��й��ۼ�
C.��̬�⻯�����ȶ��ԣ�M��I
D.Rb��Q��M������������Ӧ��ˮ�����������������Ӧ
��3��������QX�����Ժã�������ϵ��С�������õ����ȳ�����ϣ��йػ�����QX���Ʊ�����ѧ�������£������������ݾ����ۺ�Ϊ25�桢101.3 kPa�����µ���ֵ�����ٿ���Q��X�ĵ�����800��1 000���Ƶã�ÿ����1 mol QX������a kJ��������
�ڿ���Q���������̿��X�ĵ�����1 600��1 750������QX��ÿ����18 g̼����1 mol QX������b kJ��������
�����������Ϣд����������Q�����������̿��Ӧ����Q���ʺ�CO���Ȼ�ѧ����ʽ ��
��4��X��Y��ɵ�һ����ɫ������������Ϊ����ɫ����״���½�40 L����ɫ������15 L����ͨ��һ��Ũ�ȵ�NaOH��Һ�У�ǡ�ñ���ȫ���գ�ͬʱ���������Σ���д���÷�Ӧ�����ӷ���ʽ ��
���𰸡�
��1��![]()
��2��ACD
��3��Al2O3��s��+3C��s��=2Al��s��+3CO��g����H=��2b��2a�� kJ/mol
��4��8NO+3O2+8OH��=2NO2��+6NO ![]() +4H2O
+4H2O
���������⣺X��Y��Z��Q��MΪ�����Ķ�����Ԫ�أ���ԭ��������������XԪ���Ƕ�ֲ����������ȱ�ٵ�Ԫ�أ��ǵ����ʵ���Ҫ�ɷ֣���XΪNԪ�أ�YԪ���ڵؿ��к����ӵ�һλ����YΪOԪ�أ�Z�Ƕ���������ԭ�Ӱ뾶����Ԫ�أ���ZΪNa��Q�������д���ʹ����Ͻ���Ʒ����ҵ�Ͽ��õ����������ķ����Ʊ��䵥�ʣ���QΪAl��M�Ǻ�ˮ�д���������Ԫ��֮һ������������ϼ��븺�۵Ĵ�����Ϊ6����MΪCl����1��X����̬�⻯��Ĵ���������������˵���������ʳ��������µļ������������⣬����̬�⻯��ΪNH3 �� ����ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����2��A��Rb��Iͬ���ڣ��˵����Խ��ԭ�Ӱ뾶ԽС����ԭ�Ӱ뾶��Rb��I����A��ȷ�� B��RbI�к������Ӽ�����B����
����2��A��Rb��Iͬ���ڣ��˵����Խ��ԭ�Ӱ뾶ԽС����ԭ�Ӱ뾶��Rb��I����A��ȷ�� B��RbI�к������Ӽ�����B����
C���ǽ�����Cl��I������̬�⻯�����ȶ��ԣ�HCl��HI����C��ȷ��
D��Rb��Q��M������������Ӧ��ˮ����ֱ�ΪRbOH�������ᡢ����������RbOH���Ա�NaOH��ǿ��������������RbOH�������ᷴӦ��RbOH������ᷢ���кͷ�Ӧ����D��ȷ��
��ѡ��ACD����3����Al�͵����ĵ�����800��1 000���Ƶ�AlN��ÿ����1 mol AlN������a kJ���������ɵ��Ȼ�ѧ����ʽ�٣�Al��s��+ ![]() N2��g��=AlN��s����H=+a kJ/mol��
N2��g��=AlN��s����H=+a kJ/mol��
������������̿�͵���1 600��1 750������Al��ÿ����18 g̼����1 mol AlN������b kJ���������ɵ��Ȼ�ѧ����ʽ�ڣ� ![]() Al2O3��s��+
Al2O3��s��+ ![]() N2��g��+
N2��g��+ ![]() C��s��=AlN��s��+
C��s��=AlN��s��+ ![]() CO��g����H=+b kJ/mol��
CO��g����H=+b kJ/mol��
���ݸ�˹���ɣ��ڡ�2���١�2�ɵã�Al2O3��s��+3C��s��=2Al��s��+3CO��g����H=��2b��2a�� kJ/mol��
���Դ��ǣ�Al2O3��s��+3C��s��=2Al��s��+3CO��g����H=��2b��2a�� kJ/mol����4��X��Y��ɵ�һ����ɫ������������Ϊ����ɫ��������ΪNO����״���½�40 LNO��15 L����ͨ��һ��Ũ�ȵ�NaOH��Һ�У�ǡ�ñ���ȫ���գ�ͬʱ���������Σ�������NaNO2��NaNO3 �� �÷�Ӧ�����ӷ���ʽΪ��8NO+3O2+8OH��=2NO2��+6NO3��+4H2O��
���Դ��ǣ�8NO+3O2+8OH��=2NO2��+6NO3��+4H2O��

 ͬ��ѧ��һ�ζ���ϵ�д�
ͬ��ѧ��һ�ζ���ϵ�д� �����ܾ�ϵ�д�
�����ܾ�ϵ�д� ���ƿ�����ϵ�д�
���ƿ�����ϵ�д�