题目内容
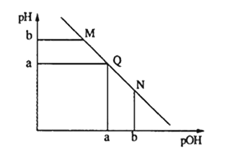
【题目】(1)溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示。
①若从A点到B点,可采取的措施为_________。
②T2 ℃时,将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,则水电离出的c(OH-)将______(填“增大”、“减小”、“不变”)。
③已知:T1 ℃时, 醋酸的电离常数为 1.8×10-5,则 T1 ℃时, 在 0.5 mol·L-1的醋酸溶液中由醋酸电离出的 c(H+)约是水电离出的 c(H+)的__________ 倍。
④T2 ℃时,将某溶液(此溶液满足 lg [c(H+)/c(OH-)]=10)滴入含 Na+、 HS-、 SO42-、 K+的溶液中,发生反应的离子方程式为___________。
(2)体积均为1 mL pH=2的一元酸HA和HB,加水稀释过程中pH与溶液体积关系如图所示:
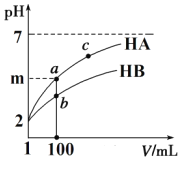
①m的取值为______________。
②a点酸的浓度____________b点酸的浓度(填 “>”、“<”、“=”)。
③若 m<4,常温下a点到c点的过程中,下列表达式的数据变大的是_____________。
A.c(A-) B. n(H+)· n(OH-) C. c(H+)/c(A-) D. c(A-)/[c(HA)· c(OH-)]
(3)已知:25 ℃时,HCN、H2CO3 的电离平衡常数分别为K=4.9×10-10,K1=4.3×10-7、K2=5.6×10-11,向NaCN溶液中通入少量CO2,所发生反应的离子方程式为:____________。
【答案】
(1)①升高温度 ②减小 ③9×108 ④H+ + HS-=H2S↑
(2)① 2<m≤4 ②< ③BC
(3)CN-+ H2O + CO2===HCN + HCO3-
【解析】
试题分析:(1)①由温度为T1时的变化图像可以看出,当x=0时,y=14(或x=14时,y=0),则该温度下水的离子积常数KW=c(H+)·c(OH-)=100×10-14=10-14,同理,温度为T2时水的离子积常数KW=c(H+)·c(OH-)=100×10-12=10-12,即B点对应水的离子积>A点对应水的离子积,因为水的电离为吸热反应,故T1<T2,所以从A点到B点,可采取的措施为升高温度。
②pH=0的NaHSO4溶液中c(H+)=1mol/L,pH=2 的醋酸溶液中c(H+)=0.01mol/L,所以将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,相当于溶液的酸性增强,水的电离受到抑制,则水电离出的c(OH-)将减小。
③因为在0.5mol/L的醋酸溶液中,由水电离出的c(H+)远远小于醋酸本身电离出的c(H+),所以在0.5mol/L的醋酸溶液中的c(H+)就可以近似认为是醋酸电离出的c(H+),醋酸的电离平衡为CH3COOHCH3COO-+H+,则有c(H+)≈c(CH3COO-),电离平衡常数计算为:1.8×10-5=![]() =
=![]() =
=![]() ,c(H+)=3×10-3mol/L,根据T1温度下水的离子积KW=10-14可知,c(OH-)=
,c(H+)=3×10-3mol/L,根据T1温度下水的离子积KW=10-14可知,c(OH-)=![]() =
=![]() =
=![]() ×10-11mol/L,则由水电离出的c(H+)=
×10-11mol/L,则由水电离出的c(H+)=![]() ×10-11mol/L。由醋酸电离出的 c(H+)是水电离出的 c(H+)的
×10-11mol/L。由醋酸电离出的 c(H+)是水电离出的 c(H+)的 =9×108倍。
=9×108倍。
④T2 ℃时,某溶液满足 lg [c(H+)/c(OH-)]=10,则有![]() =1010,即c(H+)=1010c(OH-),根据该温度下水的离子积KW=10-12可知,该溶液中c(H+)=0.1mol/L, c(OH-)=10-11mol/L,所以溶液呈酸性,可与HS-离子反应:H+ + HS-=H2S↑。
=1010,即c(H+)=1010c(OH-),根据该温度下水的离子积KW=10-12可知,该溶液中c(H+)=0.1mol/L, c(OH-)=10-11mol/L,所以溶液呈酸性,可与HS-离子反应:H+ + HS-=H2S↑。
(2)①pH=2,c(H+)=10-2mol/L,当溶液被稀释100后,pH增大,若HA为一元强酸,c(H+)=10-4mol/L,pH=4;若HA为一元弱酸,由于随着稀释电离度增大,则 c(H+)>1-4mol/L,pH<4;所以m的取值范围是2<m≤4。
②从图像曲线分析可知,两种溶液同样稀释100倍,HB的pH变化小,即c(H+)变化小,说明HB的电离平衡影响因素更大,即HB的酸性弱于HA的酸性,因为最初两者的pH均为2,则c(HB) >c(HA),同样稀释100倍后,仍有c(HB) >c(HA),所以a点酸的浓度小于b点酸的浓度。
③若 m<4,说明HA为一元弱酸,常温下a点到c点的过程就是加水稀释的过程,随着稀释,HA的电离度增大,电离出的H+、A-的物质的量增多,但由于溶液的体积增大,其浓度均减小,故A错误;因为n(H+)· n(OH-)=[ c(H+)· c(OH-)]V=KWV,因为a点到c点的过程V增大,KW为定值,所以n(H+)· n(OH-)增大,故B正确;由于在稀释过程中,HA电离出的c(H+)、c(A-)同等程度的减小,但考虑到水电离出的c(H+)在增加,所以c(H+)/c(A-)增大,故C正确;根据水的离子积可知:c(OH-)=![]() ,则
,则![]() =
= =
=![]() =
=![]() ,因为K和KW均为定值,所以
,因为K和KW均为定值,所以![]() 不变,故D错误。
不变,故D错误。
(3)向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>![]() ,故反应生成HCN和碳酸氢钠,不能生成碳酸钠,反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3,离子方程式为:CN- + H2O + CO2=HCN + HCO3-。
,故反应生成HCN和碳酸氢钠,不能生成碳酸钠,反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3,离子方程式为:CN- + H2O + CO2=HCN + HCO3-。

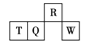
【题目】某原电池总反应的离子方程式是Fe+2Fe3+=3Fe2+ , 该原电池的组成正确的是( )
Zn | A | B | C | D |
正极 | Fe | C(石墨) | Ag | Zn |
负极 | Cu | Fe | Fe | Fe |
电解质溶液 | FeCl3 | Fe2 (SO4)3 | H2SO4 | FeCl3 |
A.A
B.B
C.C
D.D