题目内容
7.下列事实中能说明亚硝酸(HNO2)是弱电解质的是( )| A. | 0.1 mol•L-1的HNO2溶液中[H+]约为0.01 mol•L-1 | |
| B. | 用HNO2溶液做导电实验,灯泡很暗 | |
| C. | HNO2溶液不与Na2SO4溶液反应 | |
| D. | HNO2能与NaOH溶液发生中和反应 |
分析 部分电离的电解质为弱电解质,根据电解质的电离程度来分析解答,
A.根据酸中氢离子浓度和酸浓度相对大小判断;
B.溶液的导电能力与离子浓度成正比;
C.不与硫酸钠反应的酸不一定是弱酸;
D.强酸和弱酸都能够与NaOH反应.
解答 解:A、常温下0.1mol?L-1亚硝酸溶液的c(H+)为0.01mol•L-1,说明亚硝酸部分电离,则为弱电解质,故A正确;
B、溶液的导电能力与离子浓度成正比,用HNO2溶液作导电试验,灯光较暗,只能说明该酸溶液中离子浓度较小,但不能说明该酸是否完全电离,故B错误;
C、不与硫酸钠反应的酸不一定是弱酸,如硝酸,故C错误;
D、盐酸也能够与NaOH发生中和反应,故D错误;
故选A.
点评 本题考查了电解质强弱的判断,根据电解质的电离程度划分,注意电解质强弱与其溶液导电能力、中和反应等都无关,题目难度不大.

练习册系列答案
相关题目
20.已知二氯苯的同分异构体有三种,从而可以推知四氯苯的同分异构体数目是( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
18.按要求写出以下方程式:
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
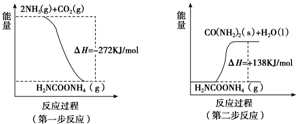
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式: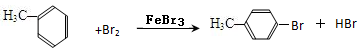 或
或
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式:
 或
或
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
15.为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )
| 方案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和(CuSO4) |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
12.在一定条件下,对于A2(g)+3B2(g)?2AB3(g)反应来说,下列所表示的化学反应速率中最大的是( )
| A. | v(A2)=0.8 mol/(L•s) | B. | v(A2)=60 mol/(L•min) | ||
| C. | v(AB3)=1.0 mol/(L•s) | D. | v(B2)=1.2 mol/(L•s) |
19.在工业生产中,硫酸不能用于( )
| A. | 制化肥 | B. | 制漂白粉 | ||
| C. | 酸洗 | D. | 医药、制炸药、农药 |
16.与0.1molH3PO4所含的氧原子数相同的是( )
| A. | 0.1molH2SO4 | B. | 0.2molH2SO3 | C. | 0.2molSO3 | D. | 0.3molCO2 |
17.某元素原子核外第二层是其他层电子数之和的2倍,则该元素的核电荷数为( )
| A. | 4 | B. | 8 | C. | 12 | D. | 16 |