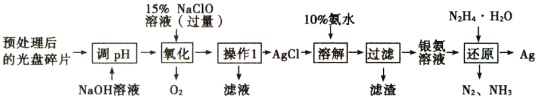
题目内容
【题目】某同学通过以下装置测定M样品(只含Fe、Al、Cu)中各成分的质量分数。取两份质量均为m g的M样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1 mL和V2 mL(已折算到标准状况下)。
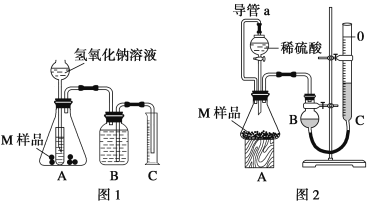
(1)写出实验1中可能发生反应的离子方程式:____________。
(2)该实验需要0.50 mol·L-1的NaOH溶液480 mL,请回答下列问题:
①配制时应用托盘天平称量______g NaOH,应选择________ ml容量瓶。
②配制NaOH溶液时,NaOH固体中含有Na2O杂质会导致所配溶液浓度________。(填“偏大”、“偏小”或“无影响”)。
(3)该实验中所用稀硫酸是用98%的浓硫酸(ρ=1.84g/cm3)配制的,则该浓硫酸的物质的量浓度是_______。
(4)对于实验2,读数时冷却至室温除视线平视外,还应进行的操作是: ___________。
(5)实验2中导管a的作用_________。
(6)M样品中铜的质量的数学表达式为(用V1和V2 表示):_______。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ 10.0 500ml 偏大 18.4 mol/L 调整BC液面相平 平衡气压使液体顺利滴下(减小氢气体积时的误差 ) ![]()
【解析】
(1)实验1中铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,铁、铜与氢氧化钠溶液不反应;
(2)①实验室中没有480ml容量瓶,配制480 mL 0.50 mol·L-1的NaOH溶液应选用500ml容量瓶;
②配制NaOH溶液时,若NaOH固体中含有Na2O杂质,,氧化钠与水反应生成氢氧化钠,会导致氢氧化钠的物质的量增大;
(3)设该硫酸的体积为1L,由题意可知浓硫酸中硫酸的物质的量为![]() =18.4mol,则物质的量浓度为
=18.4mol,则物质的量浓度为![]() =18.4mol/L;
=18.4mol/L;
(4)对于实验2,平视读数前应等到冷却到室温,并上下移动C量气管,使B、C液面相平,其目的是使B管收集的气体压强等于外界大气压;
(5)实验2中导管a的作用是平衡气压,便于液态顺利流下;
(6)由实验1可知,铝的物质的量为![]() ,由实验2可知铁的物质的量为
,由实验2可知铁的物质的量为![]() ,由此计算铜的质量。
,由此计算铜的质量。
(1)实验1中铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,铁、铜与氢氧化钠溶液不反应,则反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)①实验室中没有480ml容量瓶,配制480 mL 0.50 mol·L-1的NaOH溶液应选用500ml容量瓶,则配制时应用托盘天平称量氢氧化钠的质量为0.5L×0.50 mol·L-1×40g/mol=10.0g,故答案为:10.0;500ml;
②配制NaOH溶液时,若NaOH固体中含有Na2O杂质,,氧化钠与水反应生成氢氧化钠,会导致氢氧化钠的物质的量增大,所测结果偏大,故答案为:偏大;
(3)设该硫酸的体积为1L,由题意可知浓硫酸中硫酸的物质的量为![]() =18.4mol,则物质的量浓度为
=18.4mol,则物质的量浓度为![]() =18.4mol/L,故答案为:18.4mol/L;
=18.4mol/L,故答案为:18.4mol/L;
(4)对于实验2,平视读数前应等到冷却到室温,并上下移动C量气管,使B、C液面相平,其目的是使B管收集的气体压强等于外界大气压,这样读得的读数才准确,故答案为:调整BC液面相平;
(5)实验2中导管a的作用是平衡气压,便于液态顺利流下,若拆去导管a,加入液体时,排出锥形瓶中部分空气,导致测定的气体体积偏大,故答案为; 平衡气压使液体顺利滴下(减小氢气体积时的误差 );
(6)由实验1可知,铝的物质的量为![]() ,由实验2可知铁的物质的量为
,由实验2可知铁的物质的量为![]() ,则样品中铜的质量为m—(
,则样品中铜的质量为m—(![]() ×27g/mol)—(
×27g/mol)—(![]() ×24g/mol)=
×24g/mol)=![]() ,故答案为:
,故答案为:![]() 。
。