题目内容
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是______,烧瓶中发生的反应的化学方程式是________。
(2)画出虚线框内的实验装置图,所加试剂为____________,该装置的作用是_______。
(3)装置B中盛放的试剂是____________(填序号),实验现象为____________,该反应的离子方程式是_____________,该反应属于四种基本反应类型中的__________反应。
A Na2S溶液 B Na2SO3溶液 C Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸的酸性比硫酸强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气在加热条件下反应生成三氯化铁,铁与硫在加热条件下反应生成硫化亚铁;⑦硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子。能说明氯的非金属性比硫强的是________(填序号)。
A 全部 B ②③④⑥⑦ C ①②④⑤⑥ D ②③④⑤⑥⑦
(5)装置C中盛放烧碱溶液,目地是吸收反应后剩余的气体,防止污染空气,写出该装置中所发生反应的离子方程式:_____________。
【答案】浓盐酸 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 饱和食盐水 除去Cl2中的HCl气体 A 有淡黄色沉淀生成 S2-+Cl2=2Cl-+S↓ 置换 B Cl2+2OH-=Cl-+ClO-+H2O
MnCl2+Cl2↑+2H2O 饱和食盐水 除去Cl2中的HCl气体 A 有淡黄色沉淀生成 S2-+Cl2=2Cl-+S↓ 置换 B Cl2+2OH-=Cl-+ClO-+H2O
【解析】
根据题意,验证氯元素的非金属性比硫元素的非金属性强的原理是:氯气可以将硫从其化合物硫钠中置换出来;最高价氧化物对应水化物的酸的酸性强弱、离子的还原性强弱、氢化物的稳定性、将同样的金属氧化到的价态等进行判断。
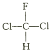
(1)装置A的作用是制取氯气,利用MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O原理可知,分液漏斗中盛装的试剂是浓盐酸。反应的方程式为: MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O原理可知,分液漏斗中盛装的试剂是浓盐酸。反应的方程式为: MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,本题答案是:浓盐酸; MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,本题答案是:浓盐酸; MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)二氧化锰和浓盐酸反应制得的氯气中含有氯化氢杂质,可以用盛有饱和食盐水的洗气瓶将其除去,虚线框内的实验装置图为: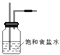 ,因此,本题正确答案是:
,因此,本题正确答案是: ;饱和食盐水;除去Cl2中的HCl气体;
;饱和食盐水;除去Cl2中的HCl气体;
(3)氯气可以将硫从其化合物中置换出来的事实可以证明氯元素的非金属性比硫元素的非金属性强,所以选择 Na2S溶液,反应的原理是: S2-+Cl2=2Cl-+S↓,有淡黄色沉淀生成,属于置换反应,因此,本题正确答案是:A;有淡黄色沉淀生成, S2-+Cl2=2Cl-+S↓;置换。
(4) ①硫酸比次氯酸稳定不能证明非金属性:Cl>S,故①错误;②最高价氧化物对应水化物的酸的酸性越强,则元素的非金属性越强, 高氯酸的酸性比硫酸强,所以Cl的非金属性强于S,故②正确;③S2-比Cl-易被氧化,说明单质的氧化性是氯气强于硫,所以Cl元素的非金属性强于S,故③正确;④元素的氢化物的稳定性越强则元素的非金属性越强,HCl比H2S稳定,所以Cl元素的非金属性强于S,故④正确;⑤铜与盐酸不反应,但能与浓硫酸反应,不能说明非金属性:Cl>S,故⑤错误;⑥单质将同样的金属氧化到的价态越高则原子的得电子能力强, 元素的非金属性越强,故⑥正确;⑦硫原子与氯原子电子层数相同,同周期元素的原子半径越小,得电子能力越强,元素的非金属性越强,故⑦正确,所以正确选项是 ②③④⑥⑦,因此,本题正确答案是:B;
(5)装置C中盛放烧碱溶液,目地是吸收反应后剩余的气体,防止污染空气,该装置中所发生反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,因此,本题正确答案是: Cl2+2OH-=Cl-+ClO-+H2O。