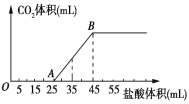
题目内容
【题目】按要求回答以下问题:
(1)写出![]() 溶液与稀硫酸反应的离子方程式___________,等物质的量的
溶液与稀硫酸反应的离子方程式___________,等物质的量的![]() 与
与![]() 固体分别与足量的硫酸反应,消耗硫酸的物质的量之比为________。
固体分别与足量的硫酸反应,消耗硫酸的物质的量之比为________。
(2)在![]() 稀
稀![]() 反应中,________是氧化剂;________是还原剂;氧化剂与还原剂的物质的量之比为__________
反应中,________是氧化剂;________是还原剂;氧化剂与还原剂的物质的量之比为__________
(3)向酸性高锰酸钾溶液中滴加硫酸亚铁,紫色逐渐褪去,写出该反应的离子方程式: _______。
(4)将![]() 的钠、镁、铝分别投入
的钠、镁、铝分别投入![]() 的硫酸溶液中,三者产生氢气的体积比是________。
的硫酸溶液中,三者产生氢气的体积比是________。
(5)等质量的Fe分别与足量的![]() 、S、
、S、![]() 反应转移电子数之比为_______;
反应转移电子数之比为_______;
【答案】HCO3—+H+=CO2↑+H2O 1:2 HNO3 Cu 2:3 5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O 3:2:2 9:6:8
【解析】
(1)碳酸氢钠溶液与稀硫酸反应生成硫酸钠、二氧化碳和水,碳酸钠固体与稀硫酸反应生成硫酸钠、二氧化碳和水,由方程式可知等物质的量的![]() 与
与![]() 固体消耗硫酸的物质的量之比;
固体消耗硫酸的物质的量之比;
(2)由题给方程式可知,氮元素化合价降低被还原,HNO3为氧化剂,铜元素化合价升高被氧化,Cu为还原剂;
(3)酸性高锰酸钾溶液中与硫酸亚铁反应生成硫酸锰、硫酸铁和水;
(4)0.3mol钠、镁、铝分别与酸完全反应消耗氢离子的物质的量为0.3mol、0.6mol、0.9mol,100ml1mol/L硫酸溶液中氢离子的物质的量为0.2mol,由方程式可知三种金属均过量,但过量的钠能与水反应;
(5)Fe与足量的氯气、硫和水蒸气反应分别生成氯化铁、氯化亚铁和四氧化三铁。
(1)碳酸氢钠溶液与稀硫酸反应生成硫酸钠、二氧化碳和水,反应的离子方程式为HCO3—+H+=CO2↑+H2O;碳酸钠固体与稀硫酸反应生成硫酸钠、二氧化碳和水,反应的离子方程式为CO32—+2H+=CO2↑+H2O,则等物质的量的![]() 与
与![]() 固体分别与足量的硫酸反应,消耗硫酸的物质的量之比为1:2,故答案为:HCO3—+H+=CO2↑+H2O;1:2;
固体分别与足量的硫酸反应,消耗硫酸的物质的量之比为1:2,故答案为:HCO3—+H+=CO2↑+H2O;1:2;
(2)由题给方程式可知,氮元素化合价降低被还原,HNO3为氧化剂,铜元素化合价升高被氧化,Cu为还原剂,氧化剂与还原剂的物质的量之比为2:3,故答案为:HNO3;Cu;2:3;
(3)酸性高锰酸钾溶液中与硫酸亚铁反应生成硫酸锰、硫酸铁和水,反应的离子方程式为5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O;
(4)0.3mol钠、镁、铝分别与酸完全反应消耗氢离子的物质的量为0.3mol、0.6mol、0.9mol,100ml1mol/L硫酸溶液中氢离子的物质的量为0.2mol,由方程式可知三种金属均过量,但过量的钠能与水反应,则三者生成氢气的物质的量比为0.3mol×![]() :0.2mol×
:0.2mol×![]() :0.2mol×
:0.2mol×![]() =3:2:2,故答案为:3:2:2;
=3:2:2,故答案为:3:2:2;
(5)Fe与足量的氯气、硫和水蒸气反应分别生成氯化铁、氯化亚铁和四氧化三铁,则等质量的Fe与足量的氯气、硫和水蒸气反应转移电子数之比为3:2:![]() =9:6:8,故答案为:9:6:8。
=9:6:8,故答案为:9:6:8。

【题目】![]() 资源化利用的方法之一是合成二甲醚(
资源化利用的方法之一是合成二甲醚(![]() 简写做
简写做![]() )。
)。![]() 催化加氢法合成
催化加氢法合成![]() ,其过程中主要发生下列反应:
,其过程中主要发生下列反应:
反应Ⅰ:![]()
![]()
反应Ⅱ:![]()
![]()
其中,反应Ⅱ分以下两步完成,请写出反应Ⅳ的热化学方程式。
反应Ⅲ:![]()
![]()
反应Ⅳ:___________。
⑴反应Ⅳ的热化学方程式为________。
⑵在![]() 和
和![]() 的起始量一定的条件下,
的起始量一定的条件下,![]() 的平衡转化率和平衡时
的平衡转化率和平衡时![]() 、
、![]() 的选择性随压强或温度的变化见下图。已知:
的选择性随压强或温度的变化见下图。已知:
![]() 的选择性
的选择性![]() ;
;
![]() 的选择性
的选择性![]()
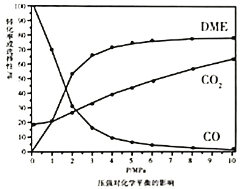

①依据图像中的数据分析,提高平衡时![]() 的选择性应当选择的条件为________。
的选择性应当选择的条件为________。
A 高温高压 B 低温低压 C 高温低压 D 低温高压
按照温度对化学平衡的影响图像分析温度低于300℃,![]() 平衡转化率随温度升高而降低的原因是_______。
平衡转化率随温度升高而降低的原因是_______。
②某温度和压强下,起始投入![]() 与足量
与足量![]() 发生反应,达到平衡时
发生反应,达到平衡时![]() 的转化率为40%,部分物质的物质的量如下表:
的转化率为40%,部分物质的物质的量如下表:
|
|
|
|
|
|
计算平衡时![]() 的选择性为________,反应Ⅳ的化学平衡常数为________。
的选择性为________,反应Ⅳ的化学平衡常数为________。
⑶经研究发现,在不同反应条件下反应相同时间(未平衡)测定发现,体系中![]() 的浓度均很低,则可知活化能大小关系:反应Ⅲ________反应Ⅳ(填“大于”、“小于”或“等于”)。
的浓度均很低,则可知活化能大小关系:反应Ⅲ________反应Ⅳ(填“大于”、“小于”或“等于”)。
⑷![]() ,投料比为
,投料比为![]() 时进行反应,
时进行反应,![]() 的浓度随时间变化如下图所示,则下列说法正确的为________。
的浓度随时间变化如下图所示,则下列说法正确的为________。
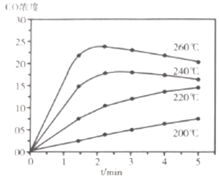
A 在![]() 范围内,反应Ⅰ的速率随温度升高而增大
范围内,反应Ⅰ的速率随温度升高而增大
B 200℃条件下,随反应时间的延长,![]() 的浓度始终增大
的浓度始终增大
C 260℃条件下,随反应时间的延长,![]() 的浓度先增大后减小最终不变
的浓度先增大后减小最终不变
D 260℃条件下,![]() 后
后![]() 的浓度减小是因为随时间推移反应Ⅱ的进行使体系中
的浓度减小是因为随时间推移反应Ⅱ的进行使体系中![]() 浓度越来越高,反应Ⅰ的逆反应速率不断增大,从而使
浓度越来越高,反应Ⅰ的逆反应速率不断增大,从而使![]() 浓度逐渐下降
浓度逐渐下降