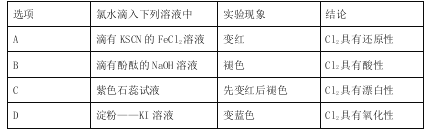
题目内容
【题目】新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。目前降低尾气的可行方法是在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:(其中a、b、c均为正值)2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。
(1)CO2的电子式为 。
(2)已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。书写在消除汽车尾气中NO2的污染时,NO2与CO的可逆反应的热化学反应方程式 。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
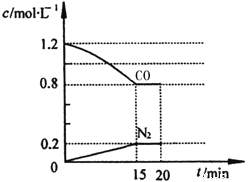
①有害气体NO的转化率为 ,0~15min NO的平均速率v(NO)= 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将 移动(选填“向左”、“向右”或“不”), 移动后在达到平衡时的平衡常数是 。
【答案】
(1)![]() (1分)
(1分)
(2)4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H="-a+b-2c" kJ·mol-1。 (2分)
N2(g)+4CO2(g) △H="-a+b-2c" kJ·mol-1。 (2分)
(3)①40% (1分) 0.027mol/(L·min) (1分) ②c d (2分)
③向左 (1分) 5/36L/mol或0.14 L/mol(2分)
【解析】
试题分析:(1)CO2的电子式 ![]() 。
。
(2)2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1 ①
N2(g)+2CO2(g) △H=-a kJ·mol-1 ①
2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1 ②
CO(g)+1/2O2(g)![]() CO2(g) △H=-c kJ·mol-1 ③
CO2(g) △H=-c kJ·mol-1 ③
由①-②+2×③得 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1。
N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1。
(3)①2CO(g)+2NO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始浓度(mol·L-1) 1.2 1 0 0
转化浓度(mol·L-1) 0.4 0.4 0.2 0.4
平衡浓度(mol·L-1) 0.8 0.6 0.2 0.4
有害气体NO的转化率为![]() ×100%=40%;
×100%=40%;
0~15min NO的平均速率v(NO)= ![]() =0.027mol/(L·min)。
=0.027mol/(L·min)。
②a.缩小容器体积,CO浓度增大,所以错误。b.增加CO的量,CO浓度增大,所以错误。c.降低温度,正向移动,CO浓度减小,所以正确。d.扩大容器体积,CO浓度减小,所以正确。所以选c d。
③20min时再向容器中充入NO、N2各0.4mol,此时各成分的浓度变为
2CO(g)+2NO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
瞬时浓度(mol·L-1) 0.8 0.6 0.4 0.6
Qc=![]() =0.625>0.14,所以逆向移动;化学平衡常数只和温度有关,温度不变,平衡常数不变,所以化学平衡常数还是
=0.625>0.14,所以逆向移动;化学平衡常数只和温度有关,温度不变,平衡常数不变,所以化学平衡常数还是![]() L/mol或0.14 L/mol。
L/mol或0.14 L/mol。