题目内容
【题目】已知在一定条件下2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
A.Q>Q1>Q2B.Q1>Q2>QC.Q1>Q>Q2D.Q1=Q2>Q
【答案】A
【解析】
由方程式2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-Q kJ·mol-1可知,2 mol SO2和1 mol O2完全反应放出的热量是Q kJ,转化率为90%,放出的热量为0.9Q kJ,即Q1=0.9Q;2 mol SO3在同一条件下只能转化10%,则吸收的热量为0.1Q kJ,即Q2=0.1Q,则Q>Q1>Q2。故选A。
2SO3(g) ΔH=-Q kJ·mol-1可知,2 mol SO2和1 mol O2完全反应放出的热量是Q kJ,转化率为90%,放出的热量为0.9Q kJ,即Q1=0.9Q;2 mol SO3在同一条件下只能转化10%,则吸收的热量为0.1Q kJ,即Q2=0.1Q,则Q>Q1>Q2。故选A。

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】几难溶物质的有关数值如表所示:下列关于含等物质的量的![]() 、
、![]() 、
、![]() 的混合溶液的说法正确的是
的混合溶液的说法正确的是![]()
物质 |
|
|
|
|
|
|
|
完全沉淀时的pH范围 |
|
|
|
A.向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀
B.该溶液中![]() :
:![]() :4
:4
C.当![]() 时,溶液中
时,溶液中![]() :
:![]() :1
:1
D.向该溶液中加入适量氨,调节pH到![]() 后过滤,将所得的沉淀灼烧,可得等物质的量的CuO、FeO、
后过滤,将所得的沉淀灼烧,可得等物质的量的CuO、FeO、![]() 三种固体的混合物
三种固体的混合物
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
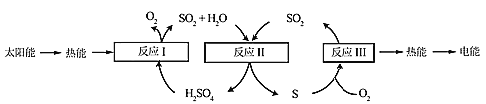
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示:
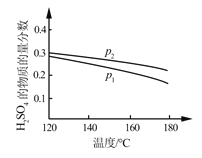
p2_______p 1(填“>”或“<”)。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+_________=_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到 2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
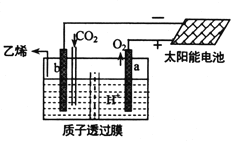
(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示。则b电极上的电极反应式为__________________。