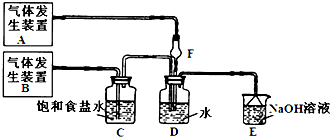
题目内容
2.现有200.00mL含MgCl2和AlCl3的混合溶液,取20.00mL该溶液于锥形瓶中,用0.20mol•L-1标准硝酸银溶液滴定,滴几滴铬酸钾(K2CrO4)溶液作指示剂,滴定,至终点时消耗标准溶液25.00mL,另取100.00mL该溶液滴加过量氢氧化钠溶液,过滤、洗涤、灼烧、称重,得固体质量为0.2000g,原溶液中c(AlCl3)为( )| A. | 0.05mol•L-1 | B. | 0.10mol•L-1 | C. | 0.30mol•L-1 | D. | 0.50mol•L-1 |
分析 Cl-和Ag+发生复分解反应生成AgCl沉淀,离子方程式为Cl-+Ag+=AgCl↓,根据AgNO3物质的量计算n(Cl-),向混合溶液中加入过量NaOH,发生反应为Mg2++OH-=Mg(OH)2↓、Al3++4OH-=AlO2-+2H2O,所以得到的沉淀是Mg(OH)2,将沉淀过滤、洗涤、灼烧,灼烧时发生的反应为Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O,所以最终得到的固体是MgO,再结合氯离子的物质的量计算c(AlCl3).
解答 解:Cl-和Ag+发生复分解反应生成AgCl沉淀,离子方程式为Cl-+Ag+=AgCl↓,20mL混合溶液消耗n(AgNO3)=0.20mol/L×0.025L=0.005mol,则100mL溶液中n(AgNO3)为0.025mol,根据离子方程式知,100mL混合溶液中n(Cl-)=0.025mol;
向混合溶液中加入过量NaOH,发生反应为Mg2++OH-=Mg(OH)2↓、Al3++4OH-=AlO2-+2H2O,所以得到的沉淀是Mg(OH)2,将沉淀过滤、洗涤、灼烧,灼烧时发生的反应为Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O,所以最终得到的固体是MgO,
n(MgO)=$\frac{0.2000g}{40g/mol}$=0.005mol,根据Mg原子守恒得100mL混合溶液中n(Mg2+)=n(MgO)=0.005mol,
根据化学式知,100mL混合溶液中镁离子需要的n(Cl-)=2n(Mg2+)=0.005mol×2=0.01mol,则100mL混合溶液中n(AlCl3)=$\frac{1}{3}$×(0.025mol-0.01mol)=0.005mol,故c(AlCl3)=$\frac{0.005mol}{0.1L}$=0.05mol/L,
故选:A.
点评 本题考查混合物有关计算,关键是明确发生反应,利用守恒法计算n(Mg2+),侧重考查学生分析计算能力,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 向石灰水中滴加小苏打溶液至Ca2+恰好沉淀:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| B. | 实验室用石灰石和稀盐酸反应制取CO2:CO32-+2H+=CO2↑+H2O | |
| C. | 铁粉投入到稀硝酸中:Fe+2H+=Fe2++H2↑ | |
| D. | Ba(OH)2溶液与MgSO4溶液恰好反应:Ba2++SO42-=BaSO4↓ |
| A. | 硝酸银与盐酸反应:AgNO3+Cl-═AgCl↓+NO3- | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Ag+Cu2+ | |
| C. | 硫酸和氯化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙溶于稀硝酸中:CO32-+2H+═H2O+CO2↑ |
| A. | 2NaOH+H2SO4═Na2SO4+2H2O | B. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | ||
| C. | Ca(OH)2+2HNO3═Ca(NO3)2+2H2O | D. | KOH+HCl═KCl+H2O |
| A. | 0.2mol/L | B. | 0.5mol/L | C. | 0.1mol/L | D. | 0.05mol/L |
| A. | 0.1mol•L-1的氨水100mL | B. | 0.1mol•L-1的醋酸50mL | ||
| C. | 0.05mol•L-1的醋酸100mL | D. | 0.05mol•L-1的硫酸100mL |