题目内容
17.有一未知浓度的硫酸溶液25mL,在加入0.1mol/L BaCl2溶液10mL后,改加NaOH溶液,结果用去0.1mol/LNaOH溶液25mL恰好完全中和,则此硫酸的物质的量浓度为( )| A. | 0.2mol/L | B. | 0.5mol/L | C. | 0.1mol/L | D. | 0.05mol/L |
分析 先根据硫酸和BaCl2反应求出反应的硫酸,再根据过量的硫酸、生成的盐酸和NaOH反应求出过量的硫酸,最后根据C=$\frac{n}{V}$求出硫酸的浓度的物质的量浓度.
解答 解:硫酸和BaCl2反应,
H2SO4 +BaCl2 =BaSO4↓+2HCl
0.001mol 0.01L×0.1mol/L 0.002mol
生成的盐酸和NaOH反应
HCl+NaOH=NaNO3 +H2O
0.002mol 0.002mol
过量的硫酸和NaOH反应
H2SO4 +2NaOH=Na2SO4 +2H2O
0.00025 0.025L×0.1mol/L-0.002mol=0.0005mol
则硫酸溶液含有硫酸0.00125mol,其物质的量浓度为$\frac{0.001mol+0.00025mol}{0.025L}$=0.05mol/L,
故选D.
点评 本题主要考查了化学计算,需要注意的是生成的盐酸和NaOH也反应,这一步很容易错,应注意审题.

练习册系列答案
相关题目
7.某温度时,测得纯水中c(H+)=2.4×10-7 mol•L-1,则c(OH-)为( )
| A. | 2.4×10-7mol•L-1 | B. | 1.0×10-7mol•L-1 | ||
| C. | $\frac{1.0×1{0}^{-14}}{2.4×10-7}$ mol•L-1 | D. | 无法确定 |
8.实验室测得4mol SO2发生下列化学反应:2SO2(g)+O2(g)═2SO3(g)△H=-196kJ/mol.当放出313.6kJ热量时,SO2转化率最接近于( )
| A. | 40% | B. | 50% | C. | 80% | D. | 90% |
5.下列叙述正确的是( )
| A. | CH4的摩尔质量为16g | |
| B. | 标准状况下,1 mol任何物质体积均为22.4 L | |
| C. | 1 mol H2O的质量为18g/mol | |
| D. | 3.01×1023个SO2分子的质量为32g |
12.粗盐中含Ca2+、Mg2+、Fe3+、SO42-及泥沙等杂质,需要提纯后才能综合利用.粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加盐酸调节溶液的pH;⑤溶解;⑥过滤; ⑦蒸发.正确的操作顺序是( )
| A. | ⑤①③②④⑥⑦ | B. | ⑤①②③⑥④⑦ | C. | ⑤③①②⑥④⑦ | D. | ⑤③②①⑥④⑦ |
2.现有200.00mL含MgCl2和AlCl3的混合溶液,取20.00mL该溶液于锥形瓶中,用0.20mol•L-1标准硝酸银溶液滴定,滴几滴铬酸钾(K2CrO4)溶液作指示剂,滴定,至终点时消耗标准溶液25.00mL,另取100.00mL该溶液滴加过量氢氧化钠溶液,过滤、洗涤、灼烧、称重,得固体质量为0.2000g,原溶液中c(AlCl3)为( )
| A. | 0.05mol•L-1 | B. | 0.10mol•L-1 | C. | 0.30mol•L-1 | D. | 0.50mol•L-1 |
13.下列标志中,应贴在装有乙醇罐车上的是( )
| A. |  | B. |  | C. |  | D. |  |
14.解决“白色污染”问题,下列做法不宜提倡的是( )
| A. | 将废弃塑料直接填埋 | B. | 对废弃塑料回收再利用 | ||
| C. | 用布袋代替塑料袋 | D. | 使用新型可降解塑料 |
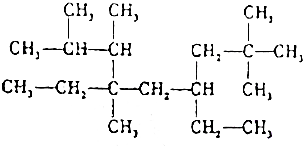 某烷结构如图所示,该烷主链碳原子数为9,该烷的名称为2,2,6,7,8-五甲基-4,6-二乙基壬烷.
某烷结构如图所示,该烷主链碳原子数为9,该烷的名称为2,2,6,7,8-五甲基-4,6-二乙基壬烷.