题目内容
【题目】(1)反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g)△H1,平衡常数为K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g)△H1,平衡常数为K1;反应②Fe(s)+H2O(g) ![]() FeO(s)+H2(g)△H2,平衡常数为K2。在不同温度时K1、K2的值如下表:
FeO(s)+H2(g)△H2,平衡常数为K2。在不同温度时K1、K2的值如下表:

反应 CO2(g) + H2(g) ![]() CO(g) + H2O(g) △H,平衡常数K,则△H=_____________________(用△H1和△H2表示),K=____________________________________(用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H,平衡常数K,则△H=_____________________(用△H1和△H2表示),K=____________________________________(用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) ![]() CO(g) + H2O(g)是___________________反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是___________________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H >0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) △H >0,CO2的浓度与时间的关系如图所示:
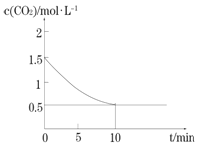
①该条件下反应的平衡常数为________________________________________;
②下列措施中能使平衡时c(CO)/c(CO2)增大的是______________________________________(填序号)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是________________________________(填字母)。
a.容器中压强不变 b.气体的密度不再改变 c.υ正(CO2)= υ逆(CO)
d.c(CO2)= c(CO) e.容器内气体总物质的量不变
【答案】△H1-△H2 K1/K2 吸热 2.0 A bc
【解析】
(1)依据题给热化学方程式,利用盖斯定律求△H,利用平衡常数公式可求平衡常数K,依据表中数据,可判断反应是吸热还是放热;
(2)①依据图中数据,计算平衡时,c(CO2)、c(CO),进而计算平衡常数;
②用平衡移动原理即勒夏特列原理分析解答;
③利用化学平衡状态定义及平衡标志解答。
(1)根据题所给的热化学方程式,依据盖斯定律,①-②可得CO2(g) + H2(g) ![]() CO(g) + H2O(g) △H= △H1-△H2,反应①的平衡常数K1=c(CO)/c(CO2),反应②的平衡常数K2=c(H2)/c(H2O),反应CO2(g)+H2(g)
CO(g) + H2O(g) △H= △H1-△H2,反应①的平衡常数K1=c(CO)/c(CO2),反应②的平衡常数K2=c(H2)/c(H2O),反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数为K=c(CO)· c(H2O)/[c(CO2)·c(H2)]=K1/K2,由表中数据可知,温度700
CO(g)+H2O(g)的平衡常数为K=c(CO)· c(H2O)/[c(CO2)·c(H2)]=K1/K2,由表中数据可知,温度700![]() 时,K1/K2=0.62,900
时,K1/K2=0.62,900![]() 时,K1/K2=1.29,温度升高,反应CO2(g)+ H2(g)
时,K1/K2=1.29,温度升高,反应CO2(g)+ H2(g) ![]() CO(g)+ H2O(g)平衡常数增大,说明是吸热反应;
CO(g)+ H2O(g)平衡常数增大,说明是吸热反应;
本题答案为:△H1-△H2 , K1/K2 ,吸热。
(2)①由图中数据及c(CO2)的变化值,可得平衡时c(CO2)=0.5mol/L,c(CO)=1.0mol/L,则平衡常数K=1mol/L/0.5mol/L=2.0;
本题答案为:2.0;
②对于Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H >0,可逆反应,A.升高温度,平衡向正反应方向移动,c(CO)/c(CO2)增大;B.增大压强,平衡不移动,c(CO)/c(CO2)不变;C. 充入一定量的CO2,平衡向正反应方向移动,c(CO)/c(CO2)为平衡常数,温度不变,平衡常数不变,c(CO)/c(CO2)不变;D. 再加入一定量铁粉,铁粉是固态,平衡不移动,c(CO)/c(CO2)不变;
FeO(s)+CO(g) △H >0,可逆反应,A.升高温度,平衡向正反应方向移动,c(CO)/c(CO2)增大;B.增大压强,平衡不移动,c(CO)/c(CO2)不变;C. 充入一定量的CO2,平衡向正反应方向移动,c(CO)/c(CO2)为平衡常数,温度不变,平衡常数不变,c(CO)/c(CO2)不变;D. 再加入一定量铁粉,铁粉是固态,平衡不移动,c(CO)/c(CO2)不变;
本题答案为:A。
③a.因为该反应为气体物质前后物质的量不变的反应,所以压强不变不能说明达到平衡状态;b.建立平衡过程中气体质量变化,容器容积不变,气体密度变化,所以气体的密度不变说明达到平衡状态;c.达到化学平衡状态用不同物质表示的正逆反应速率之比等于化学计量数之比,,而υ正(CO2)= υ逆(CO),说明反应达到平衡状态;d. c(CO2)= c(CO),不一定是平衡状态;e.因为该反应是气体物质的量不变的反应,故容器内气体总物质的量不变,不一定是平衡状态;
本题答案为:bc。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案







