题目内容
【题目】汽车尾气中的主要污染物是 NO、NO2 和 CO。处理汽车尾气,可实现绿色环保、节能减排。
(1)用 NaOH 溶液吸收 NO、NO2,当 n(NO)∶n(NO2)=1 时只生成一种盐,该盐的化学式为 _________ 。
(2)已知:①CO 的燃烧热△H1=-282 kJ·mol-1;
②N2(g)+O2(g)=2NO(g)△H2=+183 kJ·mol1。
写出 NO 和 CO 反应生成无污染性气体的热化学反应方程式______________________。
(3)在密闭容器中充入 10molCO 和 8molNO,发生反应,如图为平衡时 NO 的体积分数与温度,压强的关系。
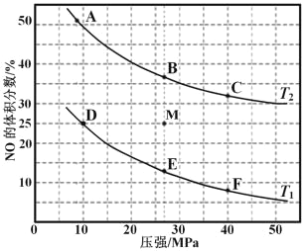
①若反应在恒容密闭容器中进行,下列图像正确且能说明反应达到平衡状态的是_____。
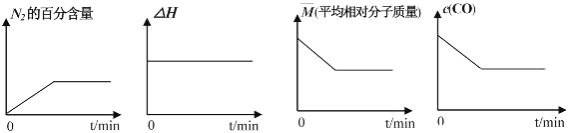
A B C D
②该反应达到平衡后,为在提高反应速率的同时提高 NO 的转化率,可采取的措施有_____(填字母)。
A.升高温度 B.缩小容器的体积
C.增加 CO 的浓度 D.改用高效催化剂
③在压强为 10MPa、温度为 T1 条件下,若反应进行到 20 min 达到平衡状态,容器的体积为 4 L,则此时 NO 的转化率=________________ ,用 N2 的浓度变化表示的平均反应速率 v(N2)= _______________,该温度下平衡常数 Kp=___________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留两位有效数字)。
④若在 M 点对反应容器降温,同时缩小体积至体系压强增大,重新达到的化学平衡状态可能是图中 A~F 点中的_____点。
【答案】NaNO22CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-747 kJ·moL-1ADBC50%0.025 mol·L-1·min-10.089F
【解析】
(1)用 NaOH 溶液吸收 NO、NO2,当 n(NO)∶n(NO2)=1 时只生成一种盐,NO中N为+2价,NO2中N为+4价,因此盐中N的化合价为+3价,故盐为NaNO2;
(2)NO 和 CO 反应生成无污染性气体,则生成氮气和二氧化碳,化学反应方程式为:2CO(g)+2NO(g)=N2(g)+2CO2(g),①CO 的燃烧热△H1=-282 kJ·mol-1,即2CO(g)+ O2(g)=2CO2(g) △H1=-564 kJ·mol-1,②N2(g)+O2(g)=2NO(g)△H2=+183 kJ·mol1,由盖斯定律得,目标方程=①-②,2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=△H1-△H2=-747 kJ·moL-1;
(3)①A、平衡时氮气的百分含量不变,说明氮气的浓度不变,因此能说明反应达平衡状态,故A正确;
B、反应的焓变与是否平衡无关,不能说明反应达平衡状态,故B错误;
C、2CO(g)+2NO(g)=N2(g)+2CO2(g)反应前后均为气体,气体密度一直保持不变,故C错误;
D、一氧化碳的浓度保持不变,能说明反应达到平衡,故D正确;
综上说述,本题应选AD;
②A、由热化学方程式2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-747 kJ·moL-1可知,该反应正反应是放热反应,升高温度,反应速率增加,但平衡逆向移动,故A不符合题意;
B、由热化学方程式2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-747 kJ·moL-1可知,正反应是体积减小的反应,缩小容器的体积,容器内压强增大,反应速率增加,平衡正向移动,NO转化率增加,故B符合题意;
C、增加 CO 的浓度,反应速率增加,且平衡正向移动,故C符合题意;
D、加入催化剂可加快反应速率,但不能影响化学平衡,故D不符合题意;
综上说述,本题应选BC;
③由图可知,在压强为 10MPa、温度为 T1 条件下,若反应进行到 20 min 达到平衡状态,为图中D点状态,NO的体积分数为25%,
设平衡时NO 转化了xmol
2CO(g)+2NO(g)=N2(g)+2CO2(g)
起始物质的量(mol) 10 8 0 0
转化物质的量(mol) x x 1/2x x
平衡物质的量(mol) 10-x 8-x 1/2x x
NO的体积分数为25%=(8-x)/(10-x+8-x+1/2x+x),解得x=4mol,则NO的转化率为4mol/8mol×100%=50%;v(N2)=![]() ;该温度下平衡常数 Kp=
;该温度下平衡常数 Kp=![]() ;
;
④由热化学方程式2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-747 kJ·moL-1可知,该反应正反应是放热反应,正反应为体积减小的反应,因此若在 M 点对反应容器降温,同时缩小体积至体系压强增大,重新达到的化学平衡状态可能是图中F点。

【题目】有机物A是一种纯净的无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A物质27.0g,升温使其汽化,测其密度是相同条件下NO的3倍 | (1)A的相对分子质量为:____________ |
(2)A的核磁共振氢谱如图:
| (2)A中含有______种氢原子 |
(3)另取A27.0g与足量的NaHCO3粉末反应,生成0.3molCO2,若与足量钠反应则生成0.3mol H2 | (3)写出A中所含官能团的名称:___________ |
(4)将此27.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者依次增重16.2g和39.6g | (4)A的分子式为:________ |
(5)综上所述A的结构简式为:_______________________________ | |




