题目内容
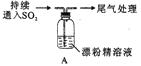
【题目】某化学兴趣小组的同学们对SO2与漂粉精、过氧化钠的反应进行实验探究:
【实验I】SO2与漂粉精反应。
操作 | 现象 |
取4g 漂粉精固体,加入100mL 水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
| 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的反应中氧化剂与还原剂的物质的量之比为__________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是____________。
(3)兴趣小组将A中产生的白雾引出导入硝酸酸化的AgN03溶液中,有沉淀产生,据此判断白雾成分为HCl小液滴,该结论合理吗?____________请说明理由____________________。
(4)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。该反应的离子方程式为______________。
(5)①将A瓶中混合物过滤、洗涤,得到沉淀X,X的成分是____________(填化学式);
② 用离子方程式解释现象3中黄绿色褪去的原因____________________。
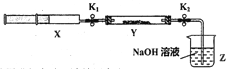
【实验II】SO2与过氧化钠反应。将一定量(过量)SO2充入注射器X中,硬质玻璃管Y中加入少量过氧化钠,两端用夹子K1、K2夹好。在室温下按图示装置进行实验,请填写空白。
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | (1)_______ | (2)反应的化学方程式:_________________ |
将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | (3)________ | (4)不用解释 |
【答案】【实验I】(1)1:1;(2)碱性、漂白性;
(3)不合理(1分);因为白雾中可能含有少量Cl2和SO2,也容易产生沉淀(1分);
(4)ClO-+Cl-+2H+=2H2O+Cl2↑;
(5)①CaSO4(1分);②SO2+Cl2+2H2O+Ca2+=CaSO4↓+2Cl-+4H+(或SO2+Cl2+2H2O=SO42-+2Cl-+4H+)
【实验II】(1)浅黄色固体变为白色;(2)SO2+Na2O2=Na2SO4;
(3)Z中NaOH溶液倒吸入Y管中
【解析】
试题分析:(1)Cl2和Ca(OH)2制取漂粉精反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,氯气既是氧化剂,也是还原剂,氯化钙是还原产物,次氯酸钙是氧化产物,因此氧化剂与还原剂的物质的量之比为1:1;
(2)pH 试纸先变蓝(约为12),后褪色,说明漂粉精溶液具有的性质是碱性、漂白性;
(3)由于白雾中可能含有少量Cl2和SO2,导入硝酸酸化的AgNO3溶液中,也容易产生沉淀,所以结论不合理;
(4)现象2中溶液变为黄绿色,说明有氯气产生,这是由于随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应,该反应的离子方程式为ClO-+Cl-+2H+=2H2O+Cl2↑;
(5)①SO2被氧化生成硫酸,进而生成硫酸钙沉淀,因此将A瓶中混合物过滤、洗涤,得到的沉淀为CaSO4;
②由于氯气能把SO2氧化为硫酸,进而产生硫酸钙沉淀,所以黄绿色褪去,反应的离子方程式为SO2+Cl2+2H2O+Ca2+=CaSO4↓+2Cl-+4H+。
【实验II】过氧化钠具有强氧化性,能把SO2氧化为硫酸钠,因此实验现象是浅黄色固体变为白色,反应的化学方程式为SO2+Na2O2=Na2SO4;将注射器活塞退回原处并固定,待装置恢复到室温,打开K2后由于SO2被吸收,压强减小,从而产生倒吸现象,所以实验现象为Z中NaOH溶液倒吸入Y管中。