题目内容
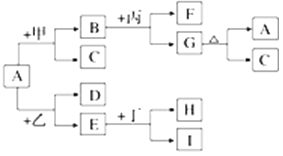
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中:C元素的原子最外层电子数是次外层电子数的三倍;A与D、C与F同主族;D是所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置________________。
(2)写出B单质的电子式________________。
(3)C、D、F三种元素形成的简单离子的半径由大到小的顺序是________(用离子符号表示)。
(4)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有_________________________。
(5)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:__________________________________________________________。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________________________________________。
(6)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式_________________________________________________________。
(7)写出由A和D形成的化合物与水反应的化学方程式_____________________。
【答案】 第三周期第ⅠA族 ![]() S2->O2->Na+ 离子键、共价键 2Al+Fe2O3
S2->O2->Na+ 离子键、共价键 2Al+Fe2O3![]() Al2O3+2Fe SiO2+2OH-===SiO
Al2O3+2Fe SiO2+2OH-===SiO![]() +H2O 2SO2+O2+2H2O===2H2SO4 NaH + H2O=== NaOH+ H2
+H2O 2SO2+O2+2H2O===2H2SO4 NaH + H2O=== NaOH+ H2
【解析】C元素的原子最外层电子数是次外层电子数的三倍,且是短周期元素,所以C是O元素,C与F同主族,且是短周期元素,所以F是S元素,D与E和F同周期,都处于第三周期,且D是所在周期原子半径最大的主族元素,所以D是Na元素,E的原子序数大于钠小于硫,所以E的单质是固体,六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素,A的单质是气体,则A的原子序数最小,所以A是H元素。
(1)D是Na元素,钠原子核外有3个电子层,最外层有1个电子,所以其在元素周期表中的位置是第三周期第IA族,故答案为:第三周期第IA族;
(2)氮气分子中氮原子间形成三键,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)电子层数越多,离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小,所以C、D、F三种元素形成的简单离子的半径由大到小的顺序是S 2->O 2->Na+,故答案为:S 2->O 2->Na+;
(4)由A、B、C三种元素以原子个数比4:2:3形成化合物X为NH4NO3,硝酸铵中所含化学键类型有离子键和共价键,故答案为:离子键、共价键;
(5)若E是金属元素,则为Al元素,铝和氧化铁能发生铝热反应,反应方程式为:2Al+Fe2O3![]() Al2O3+2Fe,若E是非金属元素,其单质在电子工业中有重要应用,则E是Si元素,二氧化硅和强碱反应生成硅酸盐和水,离子反应方程式为:SiO2+2OH-=SiO3 2-+H2O,故答案为:2Al+Fe2O3
Al2O3+2Fe,若E是非金属元素,其单质在电子工业中有重要应用,则E是Si元素,二氧化硅和强碱反应生成硅酸盐和水,离子反应方程式为:SiO2+2OH-=SiO3 2-+H2O,故答案为:2Al+Fe2O3![]() Al2O3+2Fe,SiO2+2OH-=SiO3 2-+H2O;
Al2O3+2Fe,SiO2+2OH-=SiO3 2-+H2O;
(6)SO2气体有毒,且有还原性,二氧化硫和水反应生成亚硫酸,亚硫酸易被氧气氧化生成硫酸,所以该反应的方程式为:2SO2+O2+2H2O=2H2SO4,故答案为:2SO2+O2+2H2O=2H2SO4;
(7)由A和D形成的化合物为NaH,与水反应的化学方程式为NaH + H2O=== NaOH+ H2,故答案为:NaH + H2O=== NaOH+ H2。

 全优点练单元计划系列答案
全优点练单元计划系列答案