题目内容
【题目】如图是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色.
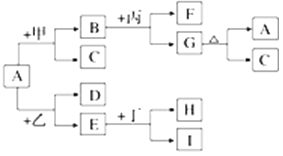
(1)若F是由Na+和SO42﹣组成的溶液,则甲的化学式是______________,列举A物质的一种用途__________________________.
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为________,丁属于单质、酸、碱中的________;在I溶液中加入氢氧化钠溶液,可以观察到的现象是_______________,对应的离子方程式和化学方程式依次是___________________________________________.
(3)写出G→A+C的化学方程式:______________________________________.
(4)写出E和C反应的方程式并用单线桥法标明电子的转移方向和数目:____________.
(5)若A中混有杂质Al2O3,除去杂质的方法是加入过量的_________,该反应的离子方程式为________________________________________________.
(6)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1.则反应物中A、E、H2SO4的物质的量之比为_________.
【答案】 H2SO4 用作红色油漆和涂料 CO 酸 生成白色沉淀,迅速变为灰绿色,最终变为红褐色 Fe2++2OH﹣=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe(OH)3![]() Fe2O3+3H2O
Fe2O3+3H2O ![]() NaOH溶液 Al2O3+2OH﹣=2AlO2﹣+H2O 1:2:4
NaOH溶液 Al2O3+2OH﹣=2AlO2﹣+H2O 1:2:4
【解析】其中A俗称铁红,化学式为Fe2O3;甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀判断为Fe(OH)3,C为H2O;I的颜色呈浅绿色,为亚铁离子的溶液,则
(1)若F是由Na+和SO42-组成的溶液,则依据转化关系得到,甲为强酸H2SO4;A为Fe2O3;铁红是非常重要的一种防锈颜料,绝大多数的涂料都添加有铁红防锈漆,如醇酸铁红防锈漆、氯化橡胶铁红防锈漆和环氧铁红防锈漆,甚至在某些环氧富锌底漆中,都以铁红作为重要辅助防锈颜料;(2)若D是能使澄清石灰水变浑浊的气体,判断乙为还原性气体CO,还原氧化铁为铁和二氧化碳气体,E为Fe,铁和丁反应生成亚铁离子证明丁为稀酸;亚铁离子和碱氢氧化钠反应生成白色沉淀氢氧化亚铁,在空气中会被迅速氧化为氢氧化铁红褐色沉淀;反应的离子方程式和化学方程式为:Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3;(3)G→A+C的化学方程式应该为氢氧化铁受热分解生成氧化铁和水的反应;反应化学方程式为:2Fe(OH)3![]() Fe2O3+3H2O;(4)铁与水反应生成四氧化三铁与氢气,Fe失去电子,H得到电子,表示式为
Fe2O3+3H2O;(4)铁与水反应生成四氧化三铁与氢气,Fe失去电子,H得到电子,表示式为![]() ;(5)氧化铁中含有氧化铝,利用氧化铝的两性进行除杂,氧化铝溶于强酸强碱溶液,氧化铁溶于强酸溶液,不溶于强碱溶液,加入过量氢氧化钠溶液,氧化铝溶解,氧化铁不溶解;反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;(6)E和A组成的混合物依据上述分析判断为Fe和Fe2O3;与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1;依据反应可知
;(5)氧化铁中含有氧化铝,利用氧化铝的两性进行除杂,氧化铝溶于强酸强碱溶液,氧化铁溶于强酸溶液,不溶于强碱溶液,加入过量氢氧化钠溶液,氧化铝溶解,氧化铁不溶解;反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;(6)E和A组成的混合物依据上述分析判断为Fe和Fe2O3;与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1;依据反应可知
Fe+H2SO4=Fe2++H2↑
1 1 1 1
Fe+2Fe3+=3Fe2+
1 2 3
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
1 3 1
因此反应物中Fe2O3、Fe、H2SO4的物质的量之比=1:2:4。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】下列试剂中无法鉴别对应物质的是
选项 | 物质 | 试剂 |
A | 乙醛 甲苯和CCl4 | 水 |
B | 甲烷 乙炔和四氯化碳 | 溴水 |
C | 乙醇 乙酸和乙酸乙酯 | 饱和碳酸钠溶液 |
D | 苯甲醇 苯甲醛和苯甲酸 | 酸性高锰酸钾溶液 |
A. A B. B C. C D. D
