��Ŀ����
����Ŀ���û�ѧ��Ӧԭ���о���������������������������Ҫ�����壮
��1����֪��2SO2��g��+O2��g��2SO3��g����H1
2NO��g��+O2��g��2NO2��g����H2
NO2��g��+SO2��g��SO3��g��+NO��g����H3
���H3= ���á�H1����H2 ��ʾ�����������������Ӧ����ʽ��ƽ�ⳣ���ֱ�ΪK1��K2��K3 �� ��K3=����K1��K2 ��ʾ����
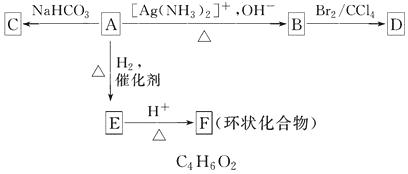
��2����ͼ1��ʾ��A�Ǻ��ݵ��ܱ�������B��һ������ɱ�ij������ң����ֺ��£��ر�K2 �� �ֱ�2mol NO ��1mol O2 ͨ��K1��K3 �ֱ����A��B �У������ķ�ӦΪ2NO��g��+O2��g��2NO2��g��[������2NO2��g��N2O4��g��]����ʼʱA��B �������ͬ��Ϊa L�� 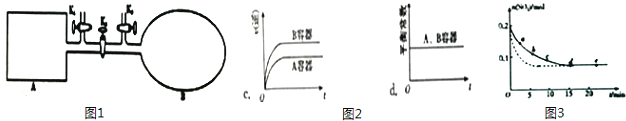
������˵����ʾ��ͼ2��ȷ���Ҽ���˵��A�����з�Ӧ�ﵽƽ��״̬������˵��B�����з�Ӧ�ﵽƽ��״̬���� ��
a��A��B �������������ɫ�����ٷ����仯
b��A��B ������NO ��O2���ʵ���Ũ�ȱȾ�Ϊ2��1
��T��ʱ��A �����з�Ӧ�ﵽƽ��ʱ��ƽ�ⳣ��Kp=8��10��2��kPa����1 �� ��A �����з�Ӧ�ﵽƽ ��ʱp��NO2��=200kPa����ƽ��ʱNO��ת����Ϊ �� ��Kp ����ƽ���ѹ����ƽ��Ũ=���ȼ�������ƽ�ⳣ������ѹ ��ѹ ���ʵ���������
��3����0.2mol SO2 ��0.15mol O2ͨ��2L ���ܱ������У����SO2�����ʵ�����ʱ��仯��ͼ3ʵ����ʾ��
��� | a | b | c | d | e |
n��SO2��/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
t/min | 2 | 5 | 8 | 15 | 22 |
��ab��ƽ����Ӧ����������ڡ���С�ڡ����ڡ���bc ��ƽ����Ӧ���ʣ�de ��ƽ����Ӧ����Ϊ ��
�ڽ��ı�ijһ��ʵ�����������SO2 �����ʵ�����ʱ��仯��ͼ3��������ʾ����ı�������� ��
���𰸡�
��1��![]() ��
��![]()
��2��a��66.7%
��3�����ڣ�0���������
����������1����2SO2��g��+O2��g��2SO3��g����H1��
��2NO��g��+O2��g��2NO2��g����H2 ��
�ɸ�˹���ɿ�֪����ӦSO2��g��+NO2��g��NO��g��+SO3��g����H= ![]() =
= ![]() ������K3=
������K3= ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
�� ![]() ��
��
2����a��A��B �������������ɫ�����ٷ����仯��˵������������Ũ�ȱ��ֲ��䣬��ƽ��״̬������ȷ��
b��������ʼ��Ϊ2��1���仯��Ϊ2��1������A��B ������NO ��O2���ʵ���Ũ�ȱ�ʼ��Ϊ2��1���ʴ���
��ѡa��
���� 2NO��g��+O2��g��2NO2��g����ʼ��Ӧ��Ͷ����2mol NO ��1mol O2 �� �迪ʼʱNOѹǿΪ2P��O2ѹǿΪP��
��ʼ��kPa�� 2P P 0
ת����kPa��200 100 200
ƽ�⣨kPa��2P��200 P��100 200
Kp= ![]() =8��10��2��kPa����1 �� ���P=150kPa��������ƽ��ʱNO��ת����Ϊ��
=8��10��2��kPa����1 �� ���P=150kPa��������ƽ��ʱNO��ת����Ϊ�� ![]() =66.7%��
=66.7%��
���Դ��ǣ�66.7%��
3�������ŷ�Ӧ�Ľ��������С������ab��ƽ����Ӧ���ʴ���bc ��ƽ����Ӧ���ʣ�de ��ƽ��״̬��Ũ�ȱ仯��Ϊ0������de ��ƽ����Ӧ����Ϊ0��
���Դ��ǣ����ڣ�0��
����ͼ��֪��Ӧ��ƽ���ʱ�����̣������������䣬�ҽ��ı�ijһ��ʵ������������ʹ�ô��������Դ��ǣ����������
�����㾫����ͨ��������÷�Ӧ�Ⱥ��ʱ�ͻ�ѧƽ��״̬���ʼ������������ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ���ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�������Խ����⣮

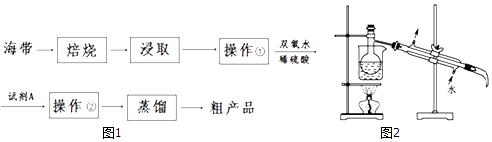
����Ŀ��������һ�ָ��������ĺ���ֲ���������������Ԫ�أ������ڵ�ĺ���ֱ��Ӱ�����彡����Ϊ�˷�ֹȱ�⣬ͨ����ʳ���м������أ�KIO3�����Բ�������Ե���������ʵ��ܶȡ��е����±���ʾ��ͼ1Ϊij��ȤС��Ӻ�������ȡ�ⵥ�ʵĹ��̣�
���� | �Ҵ� | ���Ȼ�̼ | �ѻ����� | �⣨���壩 |
�ܶ�/gcm��3 | 0.789 | 1.595 | 0.71��0.76 | 4.93 |
�е�/�� | 78.5 | 76.8 | 25��232 | 184.35 |
�ش��������⣺
��1��ʵ���ұ��պ���ʱ���ò������������� �� ����ѡ����ĸ����
A.������
B.���ż�
C.�ձ�
D.����
E.������
F.�ƾ���
��2�����ȡҺ�м���������˫��ˮ��ϡ����ʱ��������Ӧ�����ӷ���ʽΪ ��
��3���������г��õ��������⣬����Ҫ�IJ��������� ��
��4���Լ�A������Ϊ �����ϱ��������Լ���ѡ��
��5��ͼ2�ǽ�������ʱ�IJ���������ͼ��ȱ�ٵIJ��������������� ��
��6����ҵ�Ͽ��õ���ȡ����أ��䷴ӦΪI2+2KClO3�T2KIO3+Cl2���������й���������ȷ������ �� ����ѡ����ĸ����
A.�����ԣ�I2��Cl2
B.ÿ����1mol KIO3 �� ת��5mol e��
C.�÷�Ӧ���û���Ӧ
D.��Ӧ����������о����й��ۼ���