题目内容
【题目】海带是一种富含生物碘的海洋植物,碘是人体必需的微量元素,人体内碘的含量直接影响身体健康,为了防止缺碘,通常向食盐中加入碘酸钾(KIO3),以补充人体对碘的需求.各物质的密度、沸点如下表所示,图1为某兴趣小组从海带中提取碘单质的过程.
物质 | 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) |
密度/gcm﹣3 | 0.789 | 1.595 | 0.71~0.76 | 4.93 |
沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |

回答下列问题:
(1)实验室焙烧海带时,用不到的仪器有 (填选项字母).
A.泥三角
B.三脚架
C.烧杯
D.坩埚
E.蒸发皿
F.酒精灯
(2)向浸取液中加入足量的双氧水和稀硫酸时,发生反应的离子方程式为 .
(3)操作①中除用到玻璃棒外,还需要的玻璃仪器有 .
(4)试剂A的名称为 (从上表给出的试剂中选择).
(5)图2是进行蒸馏时的部分仪器,图中缺少的玻璃仪器的名称是 .
(6)工业上可用碘制取碘酸钾,其反应为I2+2KClO3═2KIO3+Cl2↑,下列有关叙述不正确的是 (填选项字母).
A.氧化性:I2>Cl2
B.每生成1mol KIO3 , 转移5mol e﹣
C.该反应是置换反应
D.反应物和生成物中均含有共价键.
【答案】
(1)CE
(2)2I﹣+H2O2+2H+═I2+2H2O
(3)烧杯、漏斗
(4)四氯化碳
(5)温度计、锥形瓶
(6)A
【解析】解:实验室从海带提取碘:海带焙烧成灰,浸泡溶解得到海带灰悬浊液,含有碘离子,加入酸和氧化剂,足量的稀硫酸和双氧水将碘离子氧化成碘单质,通过操作①过滤,得到不溶的残渣,滤液为碘单质溶液,利用有机溶剂A四氯化碳萃取出碘单质,再通过蒸馏提取出碘单质.(1)灼烧海带用坩埚盛放海带,用带铁圈的铁架台放置泥三角,泥三角上放置坩埚,用酒精灯进行加热,所以焙烧海带时需要用到的实验仪器是坩埚、带铁圈的铁架台、酒精灯、泥三角,无需用到的仪器有烧杯、蒸发皿,
故答案为:CE; (2)焙烧所得的紫菜灰主要含有碘离子,与足量的双氧水和稀硫酸作用,会发生氧化还原反应,方程式为:2I﹣+H2O2+2H+=I2+2H2O,
故答案为:2I﹣+H2O2+2H+═I2+2H2O; (3)操作①为过滤,过滤所用的玻璃仪器是烧杯、漏斗和玻璃棒,所以除用到玻璃棒外,还需要的玻璃仪器有烧杯、漏斗,
故答案为:烧杯、漏斗; (4)操作②主要是把碘单质从水中萃取到四氯化碳溶液中,然后再分液,题干中提供的四中物质,乙醇和水能互溶,不能做萃取剂,裂化汽油含有不饱和碳碳双键能与碘发生加成反应,不能做萃取剂,四氯化碳符合萃取剂的选取标准,所以可以用四氯化碳作萃取剂,
故答案为:四氯化碳;(5)蒸馏操作中用到的仪器有:酒精灯、蒸馏烧瓶、温度计、冷凝管、尾接管、锥形瓶,还缺少的玻璃仪器为:温度计、锥形瓶,
故答案为:温度计、锥形瓶;(6)2KClO3+I2=2KIO3+Cl2中,Cl元素的化合价由+5价降低为0,I元素的化合价由0升高为+5,
A.元素的非金属性越强,则单质的氧化性越强,非金属性:Cl>I,则氧化性:Cl2>I2,故A错误;
B.由反应可知,每生成1 mol KIO3转移的电子数为(5﹣0)=5mole﹣,故B正确;
C.一种单质与一种化合物反应生成另一种单质和另一种化合物的反应为置换反应,则该反应是置换反应,故C正确;
D.KClO3和KIO3中含有离子键和共价键,故D正确;
故答案为:A.
(1)灼烧海带需要的仪器有:酒精灯、三脚架、泥三角及坩埚;(2)浸取液中主要含有碘离子,与足量的双氧水和稀硫酸作用,会发生氧化还原反应,反应中I元素的化合价升高,O元素的化合价降低;(3)分离不溶性固体和液体的方法是过滤,所以操作①为过滤,过滤需要用到的玻璃仪器有漏斗、玻璃棒和烧杯;(4)操作②为萃取分液,萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,溶质和萃取剂不反应,萃取剂和原来溶剂不能互溶;(5)根据蒸馏操作方法判断需要仪器名称,然后找出还缺少的玻璃仪器名称;(6)2KClO3+I2=2KIO3+Cl2中,Cl元素的化合价由+5价降低为0,I元素的化合价由0升高为+5,结合氧化还原反应中的基本概念来解答.

【题目】用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义.
(1)已知:2SO2(g)+O2(g)2SO3(g)△H1
2NO(g)+O2(g)2NO2(g)△H2
NO2(g)+SO2(g)SO3(g)+NO(g)△H3
则△H3= (用△H1、△H2 表示),如果上述三个反应方程式的平衡常数分别为K1、K2、K3 , 则K3=(用K1、K2 表示).
(2)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2 , 分别将2mol NO 和1mol O2 通过K1、K3 分别充入A、B 中,发生的反应为2NO(g)+O2(g)2NO2(g)[不考虑2NO2(g)N2O4(g)],起始时A、B 的体积相同均为a L. 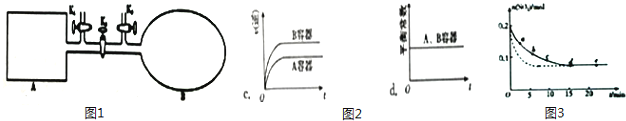
①下列说法和示意图2正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是 .
a.A、B 容器中气体的颜色均不再发生变化
b.A、B 容器中NO 和O2物质的量浓度比均为2:1
②T℃时,A 容器中反应达到平衡时的平衡常数Kp=8×10﹣2(kPa)﹣1 . 若A 容器中反应达到平 衡时p(NO2)=200kPa,则平衡时NO的转化率为 . (Kp 是用平衡分压代替平衡浓=×度计算所得平衡常数,分压 总压 物质的量分数)
(3)将0.2mol SO2 和0.15mol O2通入2L 的密闭容器中,测得SO2的物质的量随时间变化如图3实线所示.
编号 | a | b | c | d | e |
n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
t/min | 2 | 5 | 8 | 15 | 22 |
①ab段平均反应速率(填“大于”“小于”或“等于”)bc 段平均反应速率:de 段平均反应速率为 .
②仅改变某一个实验条件,测得SO2 的物质的量随时间变化如图3中虚线所示,则改变的条件是 .

