题目内容
【题目】将足量的AgCl(s)分别添加到下述四种溶液中,所得溶液c(Ag+)最小的是( )
A.10 mL 0.4molL﹣1的盐酸
B.10 mL 0.3molL﹣1 MgCl2溶液
C.10 mL 0.5molL﹣1 NaCl溶液
D.10 mL 0.1molL﹣1 AlCl3溶液
【答案】B
【解析】AgCl(s)溶解后存在溶解平衡为:AgCl(s)=Ag+(aq)+Cl﹣(aq),当增大Cl﹣浓度时,平衡逆移,Ag+的浓度会减小;所以将足量氯化银分别放入相同体积的下列溶液中,Ag+的浓度最小,则Cl﹣浓度应最大,题中B项Cl﹣浓度最大,所以B正确;所以选B.

【题目】用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义.
(1)已知:2SO2(g)+O2(g)2SO3(g)△H1
2NO(g)+O2(g)2NO2(g)△H2
NO2(g)+SO2(g)SO3(g)+NO(g)△H3
则△H3= (用△H1、△H2 表示),如果上述三个反应方程式的平衡常数分别为K1、K2、K3 , 则K3=(用K1、K2 表示).
(2)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2 , 分别将2mol NO 和1mol O2 通过K1、K3 分别充入A、B 中,发生的反应为2NO(g)+O2(g)2NO2(g)[不考虑2NO2(g)N2O4(g)],起始时A、B 的体积相同均为a L. 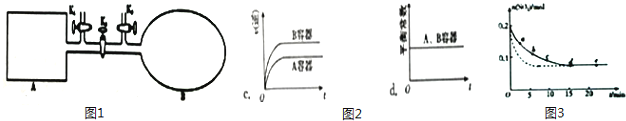
①下列说法和示意图2正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是 .
a.A、B 容器中气体的颜色均不再发生变化
b.A、B 容器中NO 和O2物质的量浓度比均为2:1
②T℃时,A 容器中反应达到平衡时的平衡常数Kp=8×10﹣2(kPa)﹣1 . 若A 容器中反应达到平 衡时p(NO2)=200kPa,则平衡时NO的转化率为 . (Kp 是用平衡分压代替平衡浓=×度计算所得平衡常数,分压 总压 物质的量分数)
(3)将0.2mol SO2 和0.15mol O2通入2L 的密闭容器中,测得SO2的物质的量随时间变化如图3实线所示.
编号 | a | b | c | d | e |
n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
t/min | 2 | 5 | 8 | 15 | 22 |
①ab段平均反应速率(填“大于”“小于”或“等于”)bc 段平均反应速率:de 段平均反应速率为 .
②仅改变某一个实验条件,测得SO2 的物质的量随时间变化如图3中虚线所示,则改变的条件是 .