题目内容
工业上常利用液晶显示屏生产过程中产生的废玻璃粉末为原料回收金属铈(Ce),金属铈是一种重要的稀土元素,原子序数为58,它有四种同位素,元素的相对原子质量为140,下列有关说法正确的是
| A.它是第五周期元素 |
| B.原子核内一定有82个中子 |
| C.铈的四种同位素形成的中性原子核外电子数相同 |
| D.Ce2+离子中有55个质子 |
C
解析试题分析:A、Ce是58号元素,位于第六周期,错误;B、铈的四种同位素原子核内中子数都不相同,且依据题目条件无法求得,错误;C、铈的四种同位素形成的中性原子核外电子数等于核内质子数,都是58,正确;D、Ce3+离子中有58个质子,错误。
考点:考查元素周期表及原子结构。

练习册系列答案
相关题目
已知33As、34Se、35Br位于同一周期,下列关系正确的是
| A.电负性:As>Cl>P | B.热稳定性:HCl>HBr>AsH3 |
| C.第一电离能:Br>Se>As | D.酸性:H3AsO4>H2SO4>H3PO4 |
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是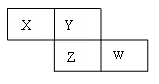
| A.气态氢化物的稳定性:X>Y |
| B.Z元素的氧化物对应的水化物一定是一种强酸 |
| C.X、Y、Z原子半径的大小顺序: X>Y>Z |
| D.X的气态氢化物与W的气态氢化物可以相互反应 |
2012年,IUPAC正式命名了116号元素,但117号元素尚未被正式认定。下列关于 的说法,错误的是
的说法,错误的是
| A.是两种原子 | B.互为同位素 |
| C.中子数分别为176和177 | D.电子数相差1 |
短周期主族元素X、Y、Z在元素周期表中的相对位置如图,下列推论合理的是
| X | Y |
| | Z |
A.若Y和Z能形成化合物,则X为氮元素
B.若X、Y、Z的单质常温下都是气体,则Y为氧元素
C.若X、Y、Z是非金属元素,则它们气态氢化物的水溶液都显酸性
D.若X、Y、Z的原子序数之和小于20,则它们都是金属元素
已知镓(31Ga)和溴(35Br)是第四周期的主族元素。下列分析正确的是
| A.与镓同主族且相邻周期的元素,其原子序数为23或49 |
| B.与镓同周期且相邻主族的元素,其原子序数为30或32 |
| C.原子半径:Br>Ga> Cl> Al |
| D.碱性:KOH>Ga(OH)3>Al(OH)3 |
下列说法正确的是
| A.酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因 |
| B.CH4、NH3、PH3的热稳定性逐渐增强 |
| C.因为酸性:HC1>HF,所以非金属性:Cl>F |
| D.钠原子在反应中失去的电子比铝原子少,故钠的金属性比铝弱 |
