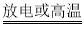题目内容
【题目】KHC2O4·H2C2O4·2H2O (四草酸钾,记作PT)是一种分析试剂。室温时,H2C2O4的pKa1、pKa2分别为1.23、4.19 (pKa=-lgKa)。下列指定溶液中微粒物质的量浓度关系错误的是
A.0.1mol·L-1 PT溶液中:c(K+)> c(HC2O4- )> c(H2C2O4)
B.0.1mol·L-1PT中滴加NaOH至溶液pH=4.19: c(Na+)-c(K+)<c(HC2O4-)-c(H2C2O4)
C.0.1mol·L-1 PT中滴加NaOH至溶液呈中性:c(K+)> c(Na+)> c(HC2O4- )>c(C2O42- )
D.0.1mol·L-1 PT与0.3mol·L-1NaOH溶液等体积混合:c(Na+)-c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
【答案】AC
【解析】
A.PT溶于水后,若HC2O4-和H2C2O4不电离也不水解,则有c(K+)=c(H2O4-)=c(H2C2O4),但是HC2O4-和H2C2O4均会电离,根据电离平衡常数大小,H2C2O4电离程度大于HC2O4-的电离程度,根据H2C2O4![]() H+HC2O4-,溶液中的HC2O4-的浓度会增加,H2C2O4浓度减小,因此c(HC2O4-)>c(K+)>c(H2C2O4),A错误,符合题意;
H+HC2O4-,溶液中的HC2O4-的浓度会增加,H2C2O4浓度减小,因此c(HC2O4-)>c(K+)>c(H2C2O4),A错误,符合题意;
B.pH=4.19,则c(H+)=10-4.19mol/L,根据pKa2=4.19,则![]() ,带入c(H+)=10-4.19mol/L,得c(C2O42-)=c(HC2O4-)。在溶液中电荷守恒,则c(Na+)+c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),根据PT中的物料守恒,有2c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)。在电荷守恒的式子中,左右加上c(H2C2O4),得c(H2C2O4)+c(Na+)+c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)+c(H2C2O4),将物料守恒的式子,带入等式的右边,得c(H2C2O4)+c(Na+)+c(K+)+c(H+)=c(OH-)+c(C2O42-)+2c(K+),左右两边消去c(K+),再根据c(C2O42-)=c(HC2O4-),可得c(H2C2O4)+c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(K+)。溶液呈酸性,c(H+)>c(OH-),则c(H2C2O4)+c(Na+)<c(HC2O4-)+c(K+),可得c(Na+)-c(K+)<c(HC2O4-)-c(H2C2O4),B正确,不选;
,带入c(H+)=10-4.19mol/L,得c(C2O42-)=c(HC2O4-)。在溶液中电荷守恒,则c(Na+)+c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),根据PT中的物料守恒,有2c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)。在电荷守恒的式子中,左右加上c(H2C2O4),得c(H2C2O4)+c(Na+)+c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)+c(H2C2O4),将物料守恒的式子,带入等式的右边,得c(H2C2O4)+c(Na+)+c(K+)+c(H+)=c(OH-)+c(C2O42-)+2c(K+),左右两边消去c(K+),再根据c(C2O42-)=c(HC2O4-),可得c(H2C2O4)+c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(K+)。溶液呈酸性,c(H+)>c(OH-),则c(H2C2O4)+c(Na+)<c(HC2O4-)+c(K+),可得c(Na+)-c(K+)<c(HC2O4-)-c(H2C2O4),B正确,不选;
C.若PT与等物质的量的NaOH反应,则H2C2O4与NaOH反应生成NaHC2O4,此时溶液中的c(K+)=c(Na+)。HC2O4-在溶液中能够电离,也能水解,其电离平衡常数Ka2=10-4.19,其水解平衡常数![]() ,电离大于水解,溶液呈酸性。现需要滴加NaOH至溶液呈中性,则NaOH的量大于PT的量,则溶液中c(K+)<c(Na+),C错误,符合题意;
,电离大于水解,溶液呈酸性。现需要滴加NaOH至溶液呈中性,则NaOH的量大于PT的量,则溶液中c(K+)<c(Na+),C错误,符合题意;
D.0.1mol·L-1PT与0.3mol·L-1NaOH溶液等体积混合,根据物料守恒,有c(Na+)=3c(K+),根据PT中的物料守恒,有2c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)。则c(Na+)-c(K+)=2c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),D正确,不选。
答案选AC。

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】下列对有关事实分析不正确的是
选项 | 事实描述 | 相关知识分析 |
A | 谚语“正月打雷麦谷堆”、“雷雨肥庄稼” | 自然固氮:N2+2O2 |
B | 成语“滴水石穿” | 包含CaCO3+CO2+H2O=Ca(HCO3)2 |
C | 《木草经集注》记载“强烧之,紫青烟起,云是真硝石也。” | “硝石”为KNO3,钾元素的焰色反应为紫色 |
D | 野外之鬼磷,其火色青,其状如炬,或聚或散,俗称鬼火,实乃诸血之磷光也。 | “磷光”是指磷化氢(PH3)自燃,将化学能转化为光能 |
A.AB.BC.CD.D
【题目】为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法均正确的一组是
选项 | 待提纯的物质 | 除杂试剂 | 分离方法 |
A | Cl2(H2O) | 饱和NaCl溶液 | 洗气 |
B | CH3CH2OH(H2O) | CaO | 蒸馏 |
C | FeCl2(FeCl3) | Cu | 过滤 |
D |
| CCl4 | 萃取 |
A.AB.BC.CD.D