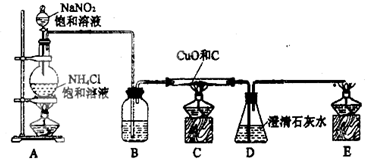
题目内容
(14分)某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2 + 2NaOH="==" NaNO3 + NaNO2 + H2O
任务1:利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。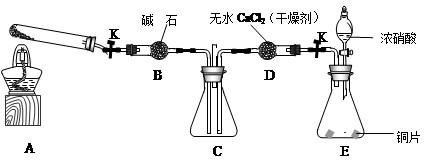
(1)E装置中制取NO2反应的化学方程式是 。
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是 。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;
③ 。
(4)此实验装置存在一个明显的缺陷是 。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3: 。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如右图所示),重新组装,进行实验。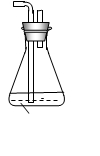
①装置的合理连接顺序是(某些装置可以重复使用) 。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为 。
(每空2分) (1)Cu + 4HNO3 (浓) ="==" Cu(NO3)2 + 2NO2↑+ 2H2O
(2)C装置中混合气体颜色变浅(其他合理答案酌情给分)
(3)在此条件下,该反应的化学反应速率极慢。
(4)缺少尾气吸收装置
(5)NO2能被Na2O2还原(其他合理答案酌情给分)
(6)① EDBDF或EDBF Na2O2 +2NO2 = 2NaNO3
解析


Ⅰ.(1)实验开始时先打开活塞K持续通入N2一段时间后,并闭K。将铜丝(足量)下移伸入浓硝酸后,有大量的红棕色气体生成,随时间的进行,气体颜色逐渐变浅,当A中充满无色气体时:
①装置A中反应的离子方程式为___________________________。
②接下来的实验操作是___________________________________。
(2)本实验中装置A的优点是____________________________。
Ⅱ.将B中所得溶液稀释至200 mL,用0.20 mol/L的NaOH溶液进行滴定。实验数据如下(硝酸的挥发分解及溶液体积的变化忽略不计):
实验编号 | 待测液体积(mL) | NaOH溶液体积(mL) |
1 | 20.00 | 15.98 |
2 | 20.00 | 14.99 |
3 | 20.00 | 15.01 |
(1)待测液的浓度为____________mol/L。
(2)硝酸与铜反应主要生成NO时硝酸的浓度不大于____________mol/L。