题目内容
7.已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-24l.8kJ/mol下列说法中错误的是( )| A. | 可推知水的分解反应属于放热反应 | |
| B. | H2与O2(g)反应放出的热量称为中和热 | |
| C. | 1mol H2完全燃烧生成液态水放出的热量小于24l.8kJ | |
| D. | 断开1molH2O的化学键吸收的总能量大于断裂lmolH2和0.5molO2的化学键所吸收的总能量 |
分析 A、依据热化学方程式可知,正反应放热,逆反应吸热;
B、中和热指强酸和强碱反应生成1mol水时放出的热量;
C、气态水变化为液体放热;
D、根据H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-24l.8kJ/mol,该反应放热分析.
解答 解:A、依据热化学方程式可知,正反应放热,逆反应吸热,所以水的分解反应属于吸热反应,故A错误;
B、中和热指强酸和强碱反应生成1mol水时放出的热量,故B错误;
C、气态水变化为液体放热,所以1mol H2完全燃烧生成液态水放出的热量大于24l.8kJ,故C错误;
D、反应是放热反应,反应物能量总和大于生成物能量总和,故断开1molH2O的化学键吸收的总能量大于断裂lmolH2和0.5molO2的化学键所吸收的总能量,故D正确;故选D.
点评 本题考查了热化学方程式的分析判断,化学反应能量变化和热化学方程式的表达意义是解题关键,题目较简单.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
10.同周期的X、Y、Z三元素,它们最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A. | 含氧酸的酸性H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性X<Y<Z | |
| C. | 元素的负化合价的绝对值按X、Y、Z减小 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序减弱 |
18.根据等电子原理,互为等电子体的微粒具有相似的空间构型.下列各组粒子的空间构型不同的是( )
| A. | CO和N2 | B. | O3和SO2 | C. | CO2和N2O | D. | N2H4和C2H4 |
15.下列离子方程式正确的是( )
| A. | 把少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═2HClO+CaSO3↓ | |
| B. | 足量铁屑溶于稀硫酸:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 铝片溶于烧碱溶液:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
2.现有部分短周期元素的性质或原子结构如下表:
下列说法正确的是( )
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子数是次外层电子数的2倍 |
| X | L层有三个未成对电子 |
| Y | L层p电子数比s电子数多两个 |
| Z | 元素的最高正价为+7价 |
| A. | z离子的结构示意图为: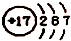 | B. | 分子TY2的键角为l80° | ||
| C. | X原子的轨道式为: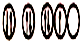 | D. | XZ3为非极性分子 |
19.下列实验操作中不正确的是 ( )
| A. | 分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液直接蒸干 | |
| D. | 称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上 |
16.下列实验能达到目的是( )
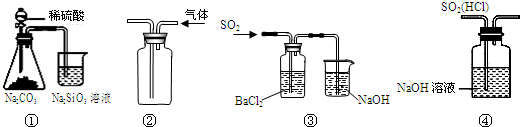

| A. | 图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②装置收集CO2气体 | |
| C. | 用图③装置制备BaSO3沉淀 | |
| D. | 用图④装置除去SO2中的HCl |
17.硼是植物生长发育必需的微量元素之一,硼玻璃纤维用作火箭的防护材料.下列关于硼的叙述正确的是( )
| A. | 它位于元素周期表第二周期第ⅡA族 | B. | 硼酸是弱酸 | ||
| C. | 硼的金属性比铝强 | D. | 硼的原子半径比碳小 |
 ,Y与W形成的原子个数比为1:1的化合物的电子式是
,Y与W形成的原子个数比为1:1的化合物的电子式是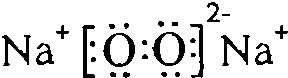 .
.