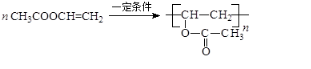
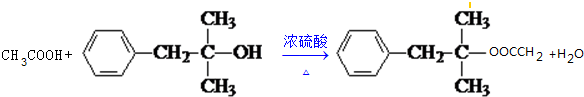
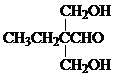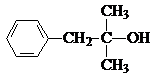题目内容
16.有一瓶澄清透明的溶液,其中可能含有H+、Ba2+、Al3+、Fe3+、NO3-、CO32-、Cl-和I-,取该溶液进行以下实验:(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入少量CCl4及数滴新制氯水,振荡后,CCl4层呈紫红色;
(3)取(2)所得到的部分上层清液,滴加硝酸酸化的AgNO3溶液,有白色沉淀生成;
(4)另取部分溶液,逐滴加入NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中和滴加完毕后,溶液中均无沉淀生成;
(5)取部分上述碱性溶液加热,滴加Na2CO3溶液,有白色沉淀生成.
根据上述实验事实确定:在该溶液中肯定存在的离子是H+、Ba2+、I-;肯定不存在的离子是Al3+、Fe3+、CO32-、NO3-;还不能确定是否存在的离子是Cl-.
分析 根据澄清溶液得,原溶液没有相互反应的离子;
(1)溶液呈强酸性,说明溶液中肯定含有H+,而H+与CO32-反应发生反应而不能共存;
(2)CCl4层呈紫红色,说明有I2,这是由于I-被氯气氧化所产生的,从而说明溶液中含有I-,而与I-反应的离子不能共存;
(3)取(2)所得到的部分上层清液,滴加硝酸酸化的AgNO3溶液,有白色沉淀生成,不能判断是否含有Cl-;
(4)另取部分溶液,逐滴加入NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中和滴加完毕后,溶液中均无沉淀生成,说明不含能与氢氧根离子反应生成沉淀的离子;
(5)取部分上述碱性溶液加热,滴加Na2CO3溶液,有白色沉淀生成,说明溶液中肯定含有Ba2+,据此解答即可.
解答 解:(1)溶液呈强酸性,说明溶液中肯定含有H+,而H+与CO32-反应发生反应而不能共存,说明溶液中肯定不含有CO32-;
(2)CCl4层呈紫红色,说明有I2,这是由于I-被氯气氧化所产生的,从而说明溶液中含有I-,而I-与Fe3+、NO3-和H+能发生氧化还原反应,而不能共存,说明溶液中肯定不含有Fe3+、NO3-;
(3)取(2)所得到的部分上层清液,滴加硝酸酸化的AgNO3溶液,有白色沉淀生成,不能判断是否含有Cl-,因为在(2)中加入的氯水,会生成Cl-,所以不能判断原溶液是否含有Cl-;
(4)另取部分溶液,逐滴加入NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中和滴加完毕后,溶液中均无沉淀生成,而Fe3+、Al3+能与碱反应产生沉淀,说明溶液中肯定不含有Fe3+、Al3+;
(5)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,说明溶液中肯定含有Ba2+;
综上所述:一定存在的离子是H+、Ba2+、I-,一定不存在的离子是Al3+、Fe3+、CO32-、NO3-,不能确定是否存在Cl-;
故答案为:H+、Ba2+、I-;Al3+、Fe3+、CO32-、NO3-;Cl-.
点评 本题考查物质的检验及鉴别,把握常见离子之间的反应、离子检验等为推断的关键,侧重分析与推断能力的综合考查,题目难度不大.

 优加精卷系列答案
优加精卷系列答案| A. | ①②③ | B. | ②③ | C. | ①③④ | D. | ①②④ |
| A. | F-的结构示意图: | |
| B. | 乙烷和丙烯互为同系物 | |
| C. | NaCl的电子式:Na${\;}_{×}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$ | |
| D. | H2、D2、T2属于同位素,化学性质几乎完全相同 |
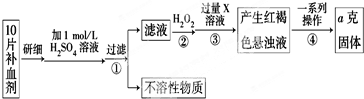

 $\stackrel{(CH_{3}CO)_{2}O}{→}$
$\stackrel{(CH_{3}CO)_{2}O}{→}$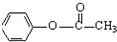
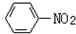 $→_{盐酸}^{Fe}$
$→_{盐酸}^{Fe}$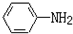
 .
. .
. .
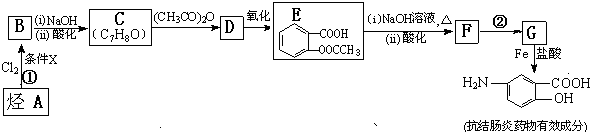
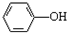
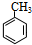
.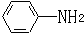 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物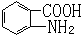 的合成路线
的合成路线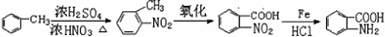 .(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
.(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
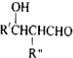 $\stackrel{△}{→}$
$\stackrel{△}{→}$
 →
→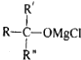 $\stackrel{H_{2}O}{→}$
$\stackrel{H_{2}O}{→}$