题目内容
1.由以下5个反应(反应条件略).A.Na2O2+O2 ═Na2CO3 ;
B.CH4 +2O2 ═CO2+2H2O;
C.2KClO3═2KCl+O2↑;
D.2Na+2H2O═2NaOH+H2↑;
E.CaCO3+2HCl═CaCl2+H2O+CO2↑
(1)属于化合反应的有A(填写编号,下同),属于分解反应的有C,属于置换反应的有D,属于复分解反应的有E;
(2)上述5个反应中,盐有5种,其中难溶于水的是CaCO3(填化学式).
分析 (1)根据两种或两种以上物质生成一种物质,为化合反应;一种物质生成多种物质的反应,为分解反应;两种化合物相互交换,生成两种新化合物的反应为复分解反应;单质与化合物反应生成新单质、新化合物的反应为置换反应,据此分析判断;
(2)根据盐的定义即由金属阳离子或者铵根离子与酸根离子结合生成的化合物以及所有的钾、钠盐都是可溶的,据此判断.
解答 解:(1)A.Na2O+CO2═Na2CO3,反应物两种,生成物一种,且没有化合价的变化,所以该反应属化合反应.
B.CH4+2O2═CO2+2H2O,该反应有化合价的变化,所以属氧化还原反应,不属于四种基本反应类型.
C.2KClO3═2KCl+3O2↑,反应物一种,生成物两种,所以该反应属分解反应.
D.2Na+2H2O═2NaOH+H2↑,该反应是单质和化合物反应生成另外的单质和化合物,所以属置换反应.
E.CaCO3+2HCl═CaCl2+H2O+CO2↑,该反应是反应物互相交换成分,生成另外两种化合物,所以属复分解反应.
故答案为:A; C; D; E;
(2)因为盐的定义为由金属阳离子或者铵根离子与酸根离子结合生成的化合物,所以上述5个反应中,盐有Na2CO3、KClO3、KCl、CaCO3、CaCl2共5种,其中难溶于水的是CaCO3,故答案为:5;CaCO3.
点评 本题考查了学生对基本概念的辨别能力,难度不大,紧扣定义判断即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.如表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | A2+与D2-的核外电子数相等 | |
| B. | B与E形成的化合物具有两性 | |
| C. | 氢化物的稳定性为H2E<H2D | |
| D. | C单质与浓度相等的稀盐酸反应比A快 |
12.2013年9月22日,宁波市公共自行车服务系统正式运营,市民办理租车卡后就可以在市区任意网点租用公共自行车,既方便出行又低碳环保.市民租用公共自行车( )
①坚持了绿色消费原则;②获得了该自行车一定的价值;③是价值规律自发调节的表现;④将减少对其互补品的消费.
①坚持了绿色消费原则;②获得了该自行车一定的价值;③是价值规律自发调节的表现;④将减少对其互补品的消费.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
16.对可逆反应A(g)+nB?2C(g),恒温下,其反应物B的转化率(αB%)与压强的关系如图,则下列叙述中正确的是( )
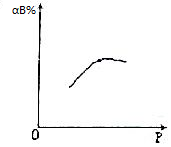

| A. | B为固体 n>1 | B. | B为液体 n>1 | C. | B为气体 n>1 | D. | B为气体 n<1 |
13.下列能正确表示反应的离子方程式的是( )
| A. | FeCl3溶液的水解:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | 氯化钡溶液与碳酸钠溶液反应:Ba2++CO32-═BaCO3 | |
| C. | 硫化亚铁与盐酸反应:FeS+2H+═Fe2++H2S | |
| D. | 氯气通入碘化钾溶液中:Cl2+2I-═I2+2Cl- |
11. 如图所示,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
如图所示,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
 如图所示,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
如图所示,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中注有浅红色的水.将气球用橡皮绳紧系在试管口.实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )| A. | U形管内的红水褪色 | B. | 试管内溶液变红 | ||
| C. | 气球a被吹大 | D. | U形管中的水位:c端高于d |
12.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 0.1molC6H6在标准状态下的体积是2.24L | |
| B. | 含有0.1molFeCl3溶液配制成氢氧化铁胶体,胶体分散质微粒小于0.1NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数为0.1NA | |
| D. | 1mol冰醋酸和1mol乙醇经催化加热反应可生成H2O分子数为NA |
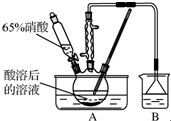 已知:氧化过程中温度需控制在55~60℃,发生的主要反应为C6H12O6+12HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3H2C2O4+9NO2↑+3NO↑+9H2O.
已知:氧化过程中温度需控制在55~60℃,发生的主要反应为C6H12O6+12HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3H2C2O4+9NO2↑+3NO↑+9H2O.