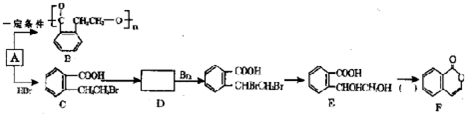
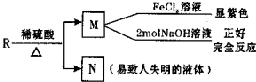
题目内容
下列依据热化学方程式得出的结论正确的是( )
| A、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ?mol-1,则氢气的燃烧热为241.8 kJ?mol-1 |
| B、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 |
| C、已知2C(s)+2O2(g)═2CO2(g)△H=a;2C(s)+O2(g)═2CO(g)△H=b,则a>b |
| D、已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 |
考点:热化学方程式
专题:化学反应中的能量变化
分析:A、依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B、依据中和热是强酸强碱稀溶液反应生成1mol水放出的热量,醋酸是弱酸电离过程是吸热过程;
C、碳燃烧生成二氧化碳放热比如说生成一氧化碳多,焓变是负值比较大小;
D、物质能量越高越活泼;
B、依据中和热是强酸强碱稀溶液反应生成1mol水放出的热量,醋酸是弱酸电离过程是吸热过程;
C、碳燃烧生成二氧化碳放热比如说生成一氧化碳多,焓变是负值比较大小;
D、物质能量越高越活泼;
解答:
解:A、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ?mol-1,生成的水是气体,不是稳定氧化物,则氢气的燃烧热大于241.8 kJ?mol-1,故A错误;
B、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,醋酸是弱酸电离过程是吸热过程,放出的热量小于57.3kJ,故B错误;
C、已知2C(s)+2O2(g)═2CO2(g)△H=a;2C(s)+O2(g)═2CO(g)△H=b,碳燃烧生成二氧化碳放热比如说生成一氧化碳多,焓变为负值,则a<b,故C错误;
D、已知C(石墨,s)═C(金刚石,s)△H>0,石墨能量低于金刚石,则石墨比金刚石稳定,故D正确;
故选D.
B、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,醋酸是弱酸电离过程是吸热过程,放出的热量小于57.3kJ,故B错误;
C、已知2C(s)+2O2(g)═2CO2(g)△H=a;2C(s)+O2(g)═2CO(g)△H=b,碳燃烧生成二氧化碳放热比如说生成一氧化碳多,焓变为负值,则a<b,故C错误;
D、已知C(石墨,s)═C(金刚石,s)△H>0,石墨能量低于金刚石,则石墨比金刚石稳定,故D正确;
故选D.
点评:本题考查了热化学方程式,燃烧热、中和热概念的理解应用,注意弱电解质电离平衡时吸热过程,题目较简单.

练习册系列答案
相关题目
某元素原子的最外层有1个电子,则该元素不可能是( )
| A、IA族元素 | B、金属元素 |
| C、非金属元素 | D、惰性元素 |
化学与生命、材料、能源等科学密切联系.下列有关化学发展方向的说法不正确的是( )
| A、研究新药物,预防和治疗人类的疾病 |
| B、研究高效、高残留农药,提高粮食产量 |
| C、开发光电转换材料,充分利用太阳能 |
| D、开发高效的模拟酶催化剂,减少对化肥的依赖 |
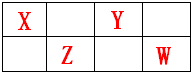 如图是元素周期表的一部分.X、Y、Z、W均为短周期元素,Z元素原子最外层电子数与电子总数之比为1:3.下列说法正确的是( )
如图是元素周期表的一部分.X、Y、Z、W均为短周期元素,Z元素原子最外层电子数与电子总数之比为1:3.下列说法正确的是( )A、X的最简单气态氢化物的球棍模型为: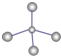 |
| B、原子半径由大到小的顺序为:W>Z>Y>X |
| C、X、Y、Z、W元素都能形成两种同素异形体 |
| D、X与Y、Z与W都能化合形成两种化合物 |
下列表示对应化学反应的离子方程式不正确的是( )
| A、FeCl3溶液与Cu的反应:Cu+2Fe3+═Cu2++2Fe2+ |
| B、向NaClO溶液中加入浓盐酸:ClO-+Cl-+2H+═Cl2↑+H2O |
| C、用氨水溶解Cu(OH)2:Cu(OH)2+4NH3?H2O═[Cu(NH3)4]2++2OH-+4H2O |
| D、向NH4HCO3中滴加少量的NaOH溶液:NH4++OH-═NH3?H2O+H2O |
下列叙述正确的是( )
| A、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| B、向FeBr2溶液中滴加少量氯水,溶液变浅黄色是因为生成了Br2 |
| C、在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 |
| D、在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液,溶液褪色,说明BaCl2溶液有酸性 |