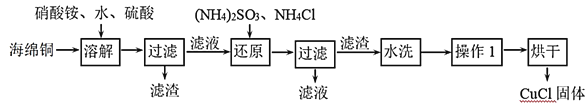
题目内容
【题目】Pbl2是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成Pbl2的实验流程如图
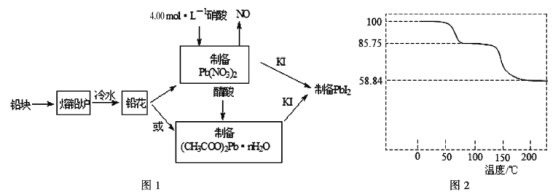
(1)将铅块制成铅花的目的是______________________________。
(2)①制备硝酸铅时,需要加热,但温度不宜过高,原因是______________________________。
②31.05g铅花用4.00 mol·L-1的硝酸溶解,化学方程式________________________________,至少需消耗4.00 mol·L-1硝酸__________mL。
(3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中在__________(填仪器名称)中加热,测得样品固体残留率(![]() ×100%)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水;(CH3COO)2Pb式量为325)。(CH3COO)2Pb·nH2O中结晶水数目n=__________(填数字)。
×100%)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水;(CH3COO)2Pb式量为325)。(CH3COO)2Pb·nH2O中结晶水数目n=__________(填数字)。
(4)称取一定质量的PhI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mLPbl2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s)+Pb2+(aq)=R2Pb(s)+2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500 mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00 mL。计算室温时PbI2的Ksp=__________。(保留4位有效数字)
【答案】增大与酸的接触面积,加快溶解反应速率 温度过高,硝酸会挥发分解 3Pb+8HNO3(稀)=3Pb(NO3)2+2NO↑+4H2O 100.0 坩埚 3 4.000×10-9
【解析】
根据影响反应速率的因素,铅块制成铅花为了增大表面积;硝酸易挥发;铅溶解于稀硝酸的反应方程式为3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,根据溶解的铅的物质的量可计算消耗的硝酸溶液的体积;固体加热用坩埚;可假设起始固体质量为100g,则加热到75℃时完全失去结晶水的质量就是固体减轻的质量,求算出水的物质的量及醋酸铅的物质的量,根据两者的物质的量之比可确定n值;根据酸碱中和的原理可计算出溶液中的H+的浓度,并结合关系式确定溶液里Pb2+的浓度,再计算Ksp,据此分析。
(1)将铅块制成铅花,是为了增大与酸反应的接触面积,加快溶解反应速率,答案为:增大与酸的接触面积,加快溶解反应速率;
(2)①硝酸受热易挥发、易分解,所以制备硝酸铅时,加热温度不宜过高答案为:温度过高,硝酸会挥发分解;
②铅和稀硝酸的反应方程式为:3Pb+8HNO3(稀)=3Pb(NO3)2+2NO↑+4H2O;31.05g铅的物质的量为![]() ,根据反应方程式可知消耗的HNO3的物质的量为
,根据反应方程式可知消耗的HNO3的物质的量为![]() ,则硝酸溶液的体积为
,则硝酸溶液的体积为![]() ;答案为: 3Pb+8HNO3(稀)=3Pb(NO3)2+2NO↑+4H2O;100.0;
;答案为: 3Pb+8HNO3(稀)=3Pb(NO3)2+2NO↑+4H2O;100.0;
(3)加热固体用坩埚,假设样品的起始质量为100g,根据固体残留率的公式可知,75℃时剩余固体为85.75g,生成的水的质量为100g-85.75g=14.25g,则醋酸铅与水的物质的量之比为:![]() ,则n=3;答案为:坩埚;3;
,则n=3;答案为:坩埚;3;
(4)n(H+)=n(NaOH)=cV=0.002500mol∕L×20.00mL×10-3 =5.000×10-5mol;根据方程式2RH(s)+Pb2+(aq)=R2Pb(s)+2H+(aq)可得n(Pb2+)=2.500×10-5mol,c(Pb2+)=![]() ;Ksp=c(Pb2+)c2 (I-)=4c3(Pb2+)=4×(1.000×10-3)3=4.000×10-9;答案为:4.000×10-9;
;Ksp=c(Pb2+)c2 (I-)=4c3(Pb2+)=4×(1.000×10-3)3=4.000×10-9;答案为:4.000×10-9;