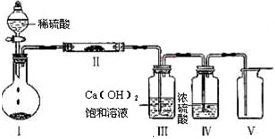
题目内容
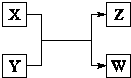 X、Y、Z、W四种物质有如右相互转化关系,X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体;Y、Z是化合物的溶液;Y溶液呈淡绿色.
X、Y、Z、W四种物质有如右相互转化关系,X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体;Y、Z是化合物的溶液;Y溶液呈淡绿色.请回答:
(1)实验室制取X的离子方程式为
4H++2Cl-+MnO2
Mn2++Cl2↑+2H2O
| ||
4H++2Cl-+MnO2
Mn2++Cl2↑+2H2O
,若制得标准状况下2.24L X,则被氧化的物质的质量为
| ||
7.3 g
7.3 g
.(2)取100mL 0.1mol/L的Y溶液,通入一定量的X时,共转移1.204×1022个电子,该反应的离子方程式是
2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2
2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2
.(3)在一种酸性溶液中可能存在Fe3+、NO
- 3 |
I-
I-
离子;一定不含有NO3-和Fe3+
NO3-和Fe3+
离子.分析:X、Y、Z、W四种物质有如右相互转化关系,X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体,所以单质W为Br2,X为Cl2;Y、Z是化合物的溶液,说明所以X+Y=Z+W是发生了氧化还原反应;Y溶液呈淡绿色说明Y溶液是亚铁盐溶液,结合判断可知为FeBr2;
(1)实验室制氯气的反应为二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水,依据离子方程式书写原则写出;根据离子方程式计算被氧化的氯化氢物质的量结合摩尔质量计算质量;
(2)100mL 0.1mol/L的Y溶液中溶质FeBr2物质的量为0.01mol,通入一定量的Cl2时,共转移1.204×1022个电子即物质的量为0.02mol,说明反应的Cl2为0.01mol,依据氧化还原反应的顺序反应分析判断计算;
(3)酸性溶液中可能存在Fe3+、NO
、Cl-、I-中的一种或几种离子,向该溶液中加入Br2被还原,证明溶液中存在还原性的离子I-,根据离子共存可知氧化性的离子Fe3+、NO
,不能存在.
(1)实验室制氯气的反应为二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水,依据离子方程式书写原则写出;根据离子方程式计算被氧化的氯化氢物质的量结合摩尔质量计算质量;
(2)100mL 0.1mol/L的Y溶液中溶质FeBr2物质的量为0.01mol,通入一定量的Cl2时,共转移1.204×1022个电子即物质的量为0.02mol,说明反应的Cl2为0.01mol,依据氧化还原反应的顺序反应分析判断计算;
(3)酸性溶液中可能存在Fe3+、NO
- 3 |
- 3 |
解答:解:X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体,所以单质W为Br2,X为Cl2;Y、Z是化合物的溶液,说明所以X+Y=Z+W是发生了氧化还原反应;Y溶液呈淡绿色说明Y溶液是亚铁盐溶液,结合判断可知为FeBr2;
(1)实验室制取氯气的离子方程式为:4H++2Cl-+MnO2
Mn2++Cl2↑+2H2O;制得标准状况下2.24L Cl2,物质的量为0.1mol,由离子方程式知,生成1molCl2被氧化的氯化氢为2mol,质量=2mol×36.5g/mol=7.3 g,故答案为:4H++2Cl-+MnO2
Mn2++Cl2↑+2H2O;7.3 g;
(2)100mL 0.1mol/L的Y溶液中溶质FeBr2物质的量为0.01mol,通入一定量的Cl2时,共转移1.204×1022个电子即物质的量为0.02mol,说明反应的Cl2为0.01mol,依据氧化还原反应中的电子守恒,亚铁离子还原性大于溴离子,亚铁离子全被氧化,溴离子部分氧化,结合定量关系写出反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2;
故答案为:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2;
(3)酸性溶液中可能存在Fe3+、NO
、Cl-、I-中的一种或几种离子,向该溶液中加入Br2被还原,证明溶液中存在还原性的离子I-,根据离子共存可知氧化性的离子Fe3+、NO
,不能存在;所以溶液中一定含有I-;一定不含NO3-和Fe3+;故答案为:I-;NO3-和Fe3+.
(1)实验室制取氯气的离子方程式为:4H++2Cl-+MnO2
| ||
| ||
(2)100mL 0.1mol/L的Y溶液中溶质FeBr2物质的量为0.01mol,通入一定量的Cl2时,共转移1.204×1022个电子即物质的量为0.02mol,说明反应的Cl2为0.01mol,依据氧化还原反应中的电子守恒,亚铁离子还原性大于溴离子,亚铁离子全被氧化,溴离子部分氧化,结合定量关系写出反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2;
故答案为:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2;
(3)酸性溶液中可能存在Fe3+、NO
- 3 |
- 3 |
点评:本题考查了元素化合物间的相互转化关系的推断,物质性质的综合应用,依据题干信息,结合转化关系判断各物质是解题关键.

练习册系列答案
相关题目





 X、Y、Z、W四种化合物均由常见元素组成,其中X含有四种元素,Y、Z含有三种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有如图转化关系(部分反应物、产物及反应条件已略去).请回答:
X、Y、Z、W四种化合物均由常见元素组成,其中X含有四种元素,Y、Z含有三种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有如图转化关系(部分反应物、产物及反应条件已略去).请回答: