题目内容
【题目】在一个温度和体积不变的容器中,硫可以发生如下变化,其反应过程和能量关系如图1所示。(SO2(g)+1/2O2(g)![]() SO3(g) △H=-98.45kJ·mol-1)
SO3(g) △H=-98.45kJ·mol-1)
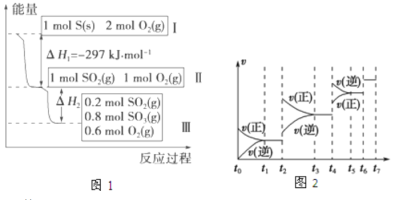
(1)硫燃烧的热化学方程式为 。
(2)恒容条件下,下列措施中能使n(SO3)/n(SO2)比图1所示情况增大的有 。
A.降低温度 B.充入He C.再充入1mol SO2(g)和1mol O2(g) D.使用催化剂
(3)恒温恒容时,图1中II到III反应放出的热量比1mol SO2和2mol O2充分反应放出的热量 (填
“大”、“小”或“相等”)。
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t2时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。(如t1~t2、t3~t4、t5~t6、t6~t7等)
【答案】(1)S(s)+O2(g)=SO2(g) △H=-297kJ·mol-1
(2)AC(3)小(4)增大压强 t3~t4
【解析】
试题分析:(1)根据图1硫燃烧饿热化学反应方程式为S(s)+O2(g)=SO2(g) △H=-297kJ·mol-1;
(2)A、降低温度,根据勒夏特列原理,平衡向正反应方向进行,比值增大,A正确;B、恒容状态下,充入非反应气体,各组分的浓度不变,比值不变,B错误;C、再充入1molSO2和1molO2,相当于在原来基础加压,平衡向正反应方向移动,比值增大,C正确;D、使用催化剂,平衡不移动,比值不变,D错误,答案选AC;
(3)通入1molSO2和2molO2,改成先通入1molSO2、1molO2,两者属于等效平衡,放出的热量相等,然后再通入1molO2,平衡向正反应方向移动,放出热量比通入1molSO2、1molO2放出热量多;
(4)t2时,正逆反应速率都增大,如果升高温度,虽然正逆反应速率都增大,但平衡向逆反应方向进行,不符合题意,增大压强,正逆反应速率都增大,平衡向体积减小的方向移动,即向正反应方向移动,符合题意,SO3含量最高,即平衡向正反应方向进行,t3~t4SO3含量最高。