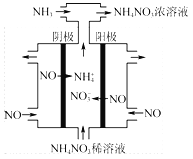
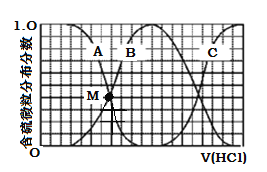
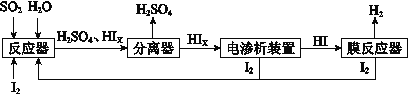
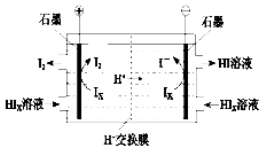
题目内容
【题目】如何除去氯化亚铁中的氯化铁,写出其化学方程式 ,其反应的离子方程式是 .
【答案】Fe+2FeCl3═3FeCl2;Fe+2Fe3+═3Fe2+.
【解析】
试题分析:除去氯化亚铁中的氯化铁,可向混合物中加入过量铁粉,将杂质氯化铁转化成氯化亚铁,据此写出反应的化学方程式、离子方程式.
解:氯化亚铁中混有氯化铁,可加入过量铁粉将氯化铁转化成氯化亚铁,反应的化学方程式为:Fe+2FeCl3═3FeCl2,离子方程式为:Fe+2Fe3+═3Fe2+,
故答案为:Fe+2FeCl3═3FeCl2;Fe+2Fe3+═3Fe2+.

练习册系列答案
相关题目