题目内容
【题目】氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等。
(1)以N2 和H2 为原料合成氢气为: N2(g) + 3 H2(g) ![]() 2NH3(g) △H=Q kJmol—1。已知键键能为946 kJmol—1 ,H-H键键能为436kJ mol—1,N-H键键能为391kJ mol—1,则Q=_______。
2NH3(g) △H=Q kJmol—1。已知键键能为946 kJmol—1 ,H-H键键能为436kJ mol—1,N-H键键能为391kJ mol—1,则Q=_______。
(2)将体积均为560 mL(标准状况下)的SO2 和Cl2 同时缓慢通A水中,得到1.0 L溶液,则溶液pH=_______。
(3)物质的量浓度相等的NH4HSO3溶液和NaHSO3 溶液中,阴离子的电离程度较小的是__________(填化学式),原因是___________ 。
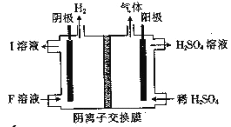
(4)用惰性电极电解NaHSO3 溶液的装置如图所示,则I是___________(填化学式,下同),阳极区放出的混合气体的成分为___________。
(5)氨水是一种常见的沉淀剂。向1.0 L 2.0×10—4molL—1的MgCl2 溶液中通入(不考虑溶液体积的变化),有白色沉淀生成。
①写出生成白色沉淀的离子方程式____________________.
②当反应中开始有白色沉淀出现时,通人的体积(标准状况)为___________mL。
(已知实验条件下NH3.H2O的电离平衡常数为1.8×l0—5,Ksp=[Mg(OH)2]=1.8×l0—11)
【答案】(1)92;
(2)1
(3)NH4HSO3;NH4+水解生成的H+抑制了HSO3—的电离;
(4)Na2SO3;O2、SO2
(5)Mg2++2NH3H2O=Mg(OH)2↓+2NH4+ ; 118.72
【解析】
试题分析:(1)根据反应热=反应物的键能总和-生成物的键能总和分析,△H=946+436×3-391×6=-92,则Q=92;(2)二氧化硫的物质的量为0.56/22.4=0.025mol,方程式为SO2+Cl2+2H2O=H2SO4+2HCl,则反应生成的氢离子的物质的量为0.1mol,溶液pH=1。(3)亚硫酸氢根离子电离出氢离子,铵根离子水解出氢离子, NH4+水解生成的H+抑制了HSO3—的电离,所以在NH4HSO3中亚硫酸氢根离子电离程度小;(4)阴极是亚硫酸氢根离子得到电子生成氢气和亚硫酸根离子,所以Ⅰ是Na2SO3;阳极是溶液中的氢氧根离子失去电子生成氧气,溶液中的氢离子浓度增大,亚硫酸氢根离子通过阴离子交换膜进入阳极室,与氢离子反应生成二氧化碳气体,所以阳极区放出的气体为O2、SO2。 (5)氯化镁和氨水反应生成氢氧化镁沉淀和氯化铵,离子方程式为:Mg2+ + 2NH3H2O = Mg(OH)2↓+2 NH4+ ;氯化镁的物质的量为2.0×10—4mol,则消耗的氨气的物质的量为2.0×10—4×2=4.0×10—4mol,则标况下的体积为4.0×10—4×22.4=118.72mL。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案