题目内容
【题目】硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+1/x Sx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/x Sx(s) △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3可以和浓HNO3反应,当生成0.6mol的H3AsO4时,反应中转移电子的数目为3NA,则As2S3和浓HNO3反应的方程式是
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS、S2的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
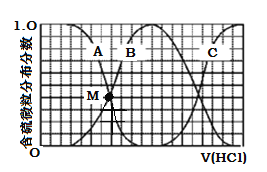
①曲线B表示 的分布分数。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。
A.c(Na+)= c(HS)+2c(S2)
B.3c(H2S)+2c(HS)+c(S2)+c(H+)=c(OH)
C.3c(Na+)=[c(H2S)+c(HS)+c(S2)]
③NaHS溶液呈碱性,当滴加盐酸至M点(A、B曲线的交叉点)时,溶液中各离子浓度由大到小的顺序为
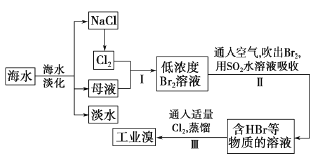
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
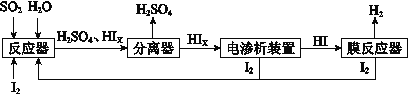
①写出反应器中发生反应的化学方程式是 。
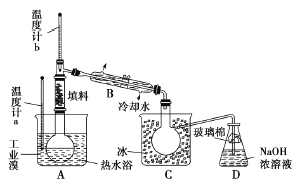
②电渗析装置如下图所示
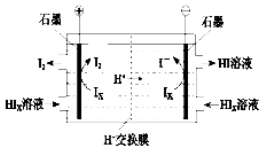
写出阳极的电极反应式 。
该装置中发生的总反应的化学方程式是 。
【答案】(1)xCOS(g)=xCO(g)+Sx(s) △H=0.5x(b a)kJ/mol
(或 2COS(g)=2CO(g)+2/xSx(s) △H=(b a)kJ/mol )
(2)As2S3+10H++ 10NO3=2H3AsO4+3S+10NO2↑+ 2H2O
(3)①HS(或NaHS) ② B ③c(Na+)> c(HS)=c(S2) >c(OH)>c(H+)
(4)①SO2 + xI2 + 2H2O = H2SO4 + 2HIX ②2Ix -2e = xI2 2HIx=(x-1) I2 + 2HI
【解析】
试题分析:(1)①SO2(g)+2CO(g)=2CO2(g)+1/x Sx(s)△H=akJ/mol,②2COS(g)+SO2(g)=2CO2(g)+3/x Sx(s) △H=bkJ/mol,根据盖斯定律,0.5x×(②-①)可得:xCOS(g)=xCO(g)+Sx(s) △H=0.5x(b a)kJ/mol。
(2)已知As2S3可以和浓HNO3反应,当生成0.6mol的H3AsO4时,反应中转移电子的数目为3NA,则生成1molH3AsO4时转移5mol电子,浓硝酸生成NO2,化合价由+5价降低到+4价,转移5mol电子时,生成5molNO2,然后根据得失电子守恒和原子守恒配平,硝酸反应失去5mol电子,As元素的化合价由+5价则As2S3和浓HNO3反应的方程式是As2S3和浓HNO3反应的方程式是As2S3+10H++ 10NO3=2H3AsO4+3S+10NO2↑+ 2H2O。
(3)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,A表示含硫微粒浓度在减小,A为Na2S,B先增加后减少为NaHS,C浓度一直在增加为H2S。
②向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS-、S2-、H2S,则c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],A、C错误;溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),再根据物料守恒:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],可得3c(H2S)+2c(HS)+c(S2)+c(H+)=c(OH),B项正确;答案选B。
③A表示Na2S,B为NaHS,当滴加盐酸至M点时,c(HS)=c(S2),发生的反应为NaOH+HCl=NaCl+H2O,Na2S+HCl=NaCl+NaHS,所以c(Na+)浓度最大,Na2S是强碱弱酸盐,溶液显碱性,NaHS的水解程度大于其电离程度,NaHS溶液显碱性,则该溶液呈碱性,c(OH-)>c(H+),所以溶液中各离子浓度由大到小的顺序为c(Na+)>c(HS)=c(S2)>c(OH)>c(H+)。
(4)①由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,反应方程式为:SO2 + xI2 +2H2O = H2SO4 + 2HIX ;
②由图2可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,所以阳极区发生的反应为:2Ix-2e = xI2,H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI,反应方程式为:2HIx=(x-1) I2 + 2HI。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案