题目内容
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
化学键 | H—O | O=O | N≡N | N—H |
键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是__________________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
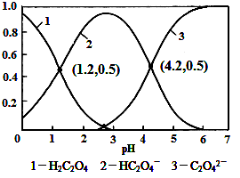
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
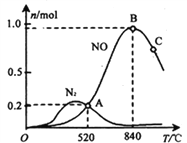
①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有_______________
A.使用催化剂Pt/Ru
B.使用催化剂Cu/TiO2
C.增大NH3和O2的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的SO2,
①若氨水与SO2恰好完全反应生成正盐,则此时溶液呈_____性(填“酸”或“碱”)常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10ˉ5mol·Lˉ1;H2SO3 :Ka1=1.3×10ˉ2mol·Lˉ1,Ka2=6.3×10ˉ8mol·Lˉ1
②上述溶液中通入______气体可使溶液呈中性,(填“SO2”或NH3”)此时溶液离子浓度由大到小的顺序_________________________________。
【答案】 △H=―1260kJ·molˉ1 A I ![]() E 碱 SO2 c(NH4+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
E 碱 SO2 c(NH4+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
【解析】(1)4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H=反应物的键能总和-生成物的键能总和
2N2(g) +6H2O(g) △H=反应物的键能总和-生成物的键能总和
=![]() =―1260kJ·molˉ1 。
=―1260kJ·molˉ1 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I,A.使用催化剂时,可降低该反应的活化能,加快其反应速率,A正确;B.若测得容器内4v正(NH3)=6v逆(H2O)时,两速率之比不等于化学计量数之比,说明反应未达平衡,B不正确;C.当容器内![]() =1时,并不能说明各组分含量保持不变,也不能说明正、逆反应速率相等,所以不能说明反应已达平衡,C不正确。
=1时,并不能说明各组分含量保持不变,也不能说明正、逆反应速率相等,所以不能说明反应已达平衡,C不正确。
(3)①根据图像结合N元素守恒可知,在高温时氨主要转化为NO,所以该催化剂在高温时选择反应I。
② 520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数可根据A点数据计算.A点对应的纵坐标为0.2,说明n(N2)=n(NO)=0.2mol,根据N元素守恒得n(NH3)=1-0.2-0.2
4NO(g) +6H2O(g)的平衡常数可根据A点数据计算.A点对应的纵坐标为0.2,说明n(N2)=n(NO)=0.2mol,根据N元素守恒得n(NH3)=1-0.2-0.2![]() =0.4mol,再根据H元素守恒得n(H2O)=
=0.4mol,再根据H元素守恒得n(H2O)= ![]() ,最后根据O元素守恒得n(O2)=2-
,最后根据O元素守恒得n(O2)=2- ![]() -
- ![]() = 1.45mol,所以K=
= 1.45mol,所以K= ![]() 。
。
③使用催化剂Pt/Ru可以加快化学反应速率,但不能提高反应物的转化率,所以A和B都不正确; C.增大NH3和O2的初始投料比会减小氨气的转化率,C不正确; D.正反应是气体分子数变多的方向,投料比不变,增加反应物的浓度相当于采取了加压的措施,加压对逆反应有利,所以氨的转化率减小,D不正确; E.正反应是放热反应,所以降低反应温度对正反应有利,有利于提高NH3转化为N2平衡转化率,所以E正确。
(4)①若氨水与SO2恰好完全反应生成正盐即亚硫酸铵,溶液中铵根和亚硫酸根都会水解,铵根水解使溶液呈酸性,而亚硫酸根水解则使溶液呈碱性,由于Ka2=6.3×10ˉ8mol·Lˉ1小于Kb=1.8×10ˉ5mol·Lˉ1,根据越弱越水解,溶液的酸碱性由水解程度更大的离子决定,所以此时溶液呈碱性。由于亚硫酸氢根的电离程度大于其水解程度,亚硫酸氢铵溶液呈酸性(由Kb和Ka1=1.3×10ˉ2mol·Lˉ1的相对大小也能得出这个结论)
②由①的分析可知上述溶液中通入SO2气体可使溶液呈中性,即常温下溶液pH=7,由Ka2=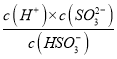 =6.3
=6.3![]() ,把c(H+)=1
,把c(H+)=1![]() 代入,得
代入,得 =6.3
=6.3![]() ,所以c(HSO3-)>c(SO32-)。此时溶液中的溶质为(NH4)2SO3和NH4HSO3的混合物,因为盐类水解的程度一般是很小的,所以溶液中离子浓度由大到小的顺序:c(NH4+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)。
,所以c(HSO3-)>c(SO32-)。此时溶液中的溶质为(NH4)2SO3和NH4HSO3的混合物,因为盐类水解的程度一般是很小的,所以溶液中离子浓度由大到小的顺序:c(NH4+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)。