题目内容
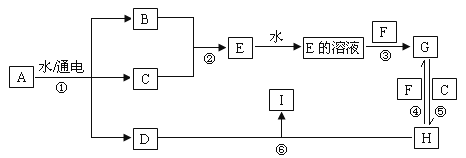
【题目】有关物质的转化关系如下图所示(部分条件已略去)。 A 为海水中含量最高的盐类物质, C 为黄绿色气体, F 为生活中常见的金属单质, I 为红褐色沉淀。
(1)E的化学式为____,I的化学式为____。
(2)写出反应①的化学方程式:____;写出反应⑤的离子方程式:____。
(3)检验 H 溶液中金属阳离子的方法是____。
(4)保存 G 溶液时要加少量固体 F 的原因是____。
【答案】HCl Fe(OH)3 2NaCl + 2H2O ![]() 2NaOH + H2↑+Cl2↑ 2Fe2+ + Cl2 = 2Fe3+ + 2Cl— 取少量H溶液于试管中,滴加KSCN溶液,若溶液变为血红色,则溶液中含Fe3+ 防止Fe2+被氧化
2NaOH + H2↑+Cl2↑ 2Fe2+ + Cl2 = 2Fe3+ + 2Cl— 取少量H溶液于试管中,滴加KSCN溶液,若溶液变为血红色,则溶液中含Fe3+ 防止Fe2+被氧化
【解析】
A 为海水中含量最高的盐类物质,则为氯化钠,电解氯化钠溶液产生氢氧化钠、氢气和氯气,C 为黄绿色气体, 则为氯气, F 为生活中常见的金属单质, I 为红褐色沉淀,根据流程中物质推知,D为氢氧化钠,C为氯气,氯气和氢气反应生成E为氯化氢,氯化氢的水溶液盐酸与F反应,以及G与H的转化可知,F为铁,G为为氯化亚铁,H为氯化铁,I为氢氧化铁,据此分析。
A 为海水中含量最高的盐类物质,则为氯化钠,电解氯化钠溶液产生氢氧化钠、氢气和氯气,C 为黄绿色气体, 则为氯气, F 为生活中常见的金属单质, I 为红褐色沉淀,根据流程中物质推知,D为氢氧化钠,C为氯气,氯气和氢气反应生成E为氯化氢,氯化氢的水溶液盐酸与F反应,以及G与H的转化可知,F为铁,G为为氯化亚铁,H为氯化铁,I为氢氧化铁。
(1)E为氯化氢,其化学式为HCl,I为氢氧化铁,其化学式为Fe(OH)3;
(2)反应①是电解氯化钠溶液得到氢氧化钠、氯气和氢气,反应的化学方程式为:2NaCl + 2H2O![]() 2NaOH + H2↑+Cl2↑;
2NaOH + H2↑+Cl2↑;
反应⑤是氯化亚铁与氯气反应生成氯化铁,反应的离子方程式为:2Fe2+ + Cl2 = 2Fe3+ + 2Cl—;
(3)检验 H 溶液中金属阳离子铁离子的方法是取少量H溶液于试管中,滴加KSCN溶液,若溶液变为血红色,则溶液中含Fe3+;
(4)保存 G 溶液时要加少量固体 F 的原因是防止Fe2+被氧化。

 备战中考寒假系列答案
备战中考寒假系列答案