题目内容
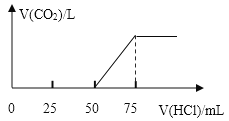
【题目】取一定物质的量浓度的 NaOH 溶液 100 mL,向其中通入一定量的 CO2 气体,得到溶液 A,向A 中逐滴缓慢加入 2.00mol/L 的 HCl 溶液,产生的 CO2 气体体积 (标准状况)与所加 HCl 溶液的体积之间关系如图所示,请回答(结果留三位有效数字):
(1)A 溶液中的溶质_________。(用化学式表示)
(2)通入的 CO2 的体积(标准状况)为______L。
(3)原 NaOH 溶液的物质的量浓度_____mol/L。
【答案】NaOH、Na2CO3 1.12 1.50
【解析】
CO2与NaOH溶液反应有如下两种“边界”情况:
CO2+2NaOH=Na2CO3+H2O…①;CO2+NaOH=NaHCO3…②;
故反应后溶液中溶质的成分可有如下四种可能:Na2CO3和NaOH、Na2CO3、Na2CO3和NaHCO3、NaHCO3;
当将稀盐酸逐滴滴到碳酸钠溶液中时,Na2CO3跟盐酸的反应是分步进行的:
Na2CO3+HCl= NaHCO3+NaCl…③
NaHCO3+HCl=NaCl+H2O+CO2↑…④
并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等。
若溶液中还有氢氧化钠,则首先发生反应:NaOH+HCl=NaCl+H2O…⑤
50mL~75mL发生的反应为HCO3-+H+=H2O+CO2↑,小于50mL,说明加入盐酸50mL前发生的反应分别为H++OH-=H2O,
CO32-+H+=HCO3-,结合反应的离子方程式和质量守恒的角度解答该题。
CO2与NaOH溶液反应有如下两种“边界”情况:
CO2+2NaOH=Na2CO3+H2O…①;CO2+NaOH=NaHCO3…②;
故反应后溶液中溶质的成分可有如下四种可能:Na2CO3和NaOH、Na2CO3、Na2CO3和NaHCO3、NaHCO3;
当将稀盐酸逐滴滴到碳酸钠溶液中时,Na2CO3跟盐酸的反应是分步进行的:
Na2CO3+HCl= NaHCO3+NaCl…③
NaHCO3+HCl=NaCl+H2O+CO2↑…④
并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等。
若溶液中还有氢氧化钠,则首先发生反应:NaOH+HCl=NaCl+H2O…⑤
分析题中的图象:
设反应产生CO2之前消耗盐酸的体积为V1,从开始产生CO2至反应结束消耗盐酸的体积为V2。
(1)V1=50mL,V2=75mL-50mL=25mL<V1,据此判断溶液中溶质的成分是Na2CO3和NaOH。
故答案为:Na2CO3和NaOH;
(2)50mL~75mL发生的反应为HCO3-+H+=H2O+CO2↑,n(HCl)=0.025L×2.00mol/L=0.05mol,
则V(CO2)=0.05mol×22.4L/mol=1.12L,
故答案为:1.12;
(3)当加入盐酸75mL时,溶液溶质为NaCl,此时n(Na+)=n(HCl)=0.075L×2.00mol/L=0.150mol,
所以n(NaOH)=0.150mol,
c(NaOH)=![]() =1.50mol/L,
=1.50mol/L,
故答案为:1.50。