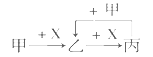题目内容
【题目】下列关于物质的量浓度表述正确的是( )
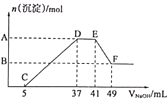
A.98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B.当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1molL-1 , 只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1molL-1
C.只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D.50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
【答案】B
【解析】A由物质的量浓度和质量分数的换算公式得: ![]()
![]() ;解得:
;解得: ![]() ,但是浓度不同,密度一定不同,说明此说法错误。A不符合题意。
,但是浓度不同,密度一定不同,说明此说法错误。A不符合题意。
B中说法正确,计算物质的量浓度时,应该用溶液总体积,显然2L水吸收44.8L氨气(标况)时所得氨水的体积不可能是2L,B符合题意。
C只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,说明K2SO4和NaCl的物质的量相等,所以K+和Cl-的物质的量浓度一定为2:1,C不符合题意。
D中50mL 1mol/L的AlCl3溶液中的Cl—浓度为3mol/L,50ml 3mol/L的BaCl2溶液Cl—浓度为6mol/L(注意这里浓度计算实际与溶液体积无关),所以D不符合题意。
所以答案是:B

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质.用硼泥生产氢氧化镁的工艺流程如图所示: 
已知某些氢氧化物沉淀的pH如下表所示:
氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
Mg(OH)2 | 9.3 | 10.8 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
(1)MgO的电子式为 .
(2)滤渣2的主要成分是 , 向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为 .
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为 .
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4 , 可以使烟气脱硫,该反应的化学方程式为 .
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为(用含有a、b的代数式表示).