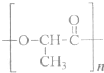题目内容
现有Na2CO3、NaHCO3和NaCl的混合物100 g,加热至质量不再减少为止,剩余固体?84.5 g,将固体溶于水,滴入足量的AgNO3溶液,得白色沉淀,加足量的稀硝酸后大部分沉淀溶解消失,剩余沉淀为12.27 g,试计算Na2CO3、NaHCO3和NaCl的质量分数各是多少。
53.0%;42.0%;5.00%。
解析:发生反应:
2NaHCO3![]() Na2CO3+H2O+CO2↑ ①
Na2CO3+H2O+CO2↑ ①
Ag++Cl-====AgCl↓ ②
2Ag++![]() ====Ag2CO3↓ ③
====Ag2CO3↓ ③
Ag2CO3+2H+====H2O+CO2↑+2Ag+ ④
![]()
m(NaCl)=12.27 g÷143.5 g·mol-1×58.5 g·mol-1=5.0 g,
m(Na2CO3)=100 g-47 g=53 g。

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
 (2012?闸北区一模)碳酸钠和碳酸氢钠在生产、生活中都有重要的应用.现有3.58g Na2CO3和NaHCO3固体混合物,将其制成溶液后,边搅拌边逐滴滴加80.0mL 1.0mol/L盐酸,反应完全后生成的CO2气体折算成标准状况下的体积为896mL(设气体全部逸出,下同).(1)通过计算可知上述反应中
(2012?闸北区一模)碳酸钠和碳酸氢钠在生产、生活中都有重要的应用.现有3.58g Na2CO3和NaHCO3固体混合物,将其制成溶液后,边搅拌边逐滴滴加80.0mL 1.0mol/L盐酸,反应完全后生成的CO2气体折算成标准状况下的体积为896mL(设气体全部逸出,下同).(1)通过计算可知上述反应中