题目内容
亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:
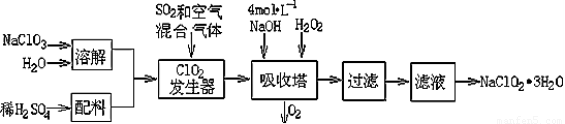
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O ;
②Ksp(FeS)=6.3×10-18 ; Ksp(CuS)=6.3×10-36 ;Ksp(PbS)=2.4×10-28
(1)吸收塔内发生反应的离子方程式为?????????????????????????????????????? 。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2。若用二氧化氯和浓盐酸制取Cl2,当生成5 mol Cl2时,通过还原反应制得氯气的质量为??? g。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是??????????????? (填写序号)。
a蒸馏;b灼烧;c过滤;d冷却结晶;e蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。
下表是 25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | HCN | H2S |
Ka/mol?L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10?8 K2=1.1×10?12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为????? (用化学式表示);体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:?? (填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是??????????????? ;当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为???????????????? 。
(1)2ClO2 + H2O2 + 2OH- = 2ClO22—+ O2+ 2H2O;? 71 ;
(2)edc
(3)① Na2S>NaCN>NaF>NaClO2; 前者大;?? ② CuS; 6.3×10-13mol/L
【解析】
试题分析:(1)根据题给化学工艺流程图知,吸收塔内为ClO2、氢氧化钠和过氧化氢反应生成NaClO2、氧气和水,离子方程式为2ClO2 + H2O2 + 2OH- = 2ClO22—+ O2+ 2H2O;若用二氧化氯和浓盐酸制取Cl2,二氧化氯是氧化剂,发生还原反应,浓盐酸是还原剂,发生氧化反应,根据电子守恒可知4n(ClO2)=n(HCl),还原产物与氧化产物物质的量之比为1:4,故还原反应生成的氯气为1mol,质量为71g;(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次蒸发浓缩、冷却结晶、过滤,答案为edc;(3)①根据题给电离平衡常数可知酸性强弱顺序为:HClO2>HF>HCN>HS-,根据盐类水解规律:酸性越弱,对应钠盐中酸根离子水解程度越大,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为Na2S>NaCN>NaF>NaClO2;由于酸性:根据二者的水解方程式判断,体积
相等,物质的量浓度相同的NaF、NaCN溶液中阴离子总数相等;由于酸性:HF>HCN,则碱性:NaCN>NaF,NaCN溶液中氢氧根浓度大于NaF溶液中氢氧根浓度,NaCN溶液氢离子浓度较小,而两溶液中钠离子浓度相等,则溶液中阳离子总数:NaCN<NaF;溶液中所含阴阳离子总数的大小关系为:前者大;②根据阴阳离子个数比相同的难溶物,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀,故首先析出沉淀是CuS,Fe2+最后沉淀,沉淀完全时该浓度为10-5mol?L-1,此时的S2-的浓度为6.3×10-18/10?5=6.3×10-13mol/L。
考点:以亚氯酸钠制备的工艺流程为载体,考查离子方程式的书写、氧化还原反应计算、物质分离提纯、盐类水解、沉淀溶解平衡。

(10分)氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O  HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。
①下列溶液能吸收Cl2的是 (填字母序号)。
| A.饱和食盐水 | B.饱和Na2SO3溶液 |
| C.饱和NaOH溶液 | D.浓硫酸 |
(10分)氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O
 HCl
+ HClO K=4.5×10-4
HCl
+ HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。
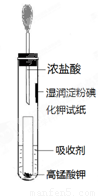
①下列溶液能吸收Cl2的是 (填字母序号)。
A. 饱和食盐水 B. 饱和Na2SO3溶液
C. 饱和NaOH溶液 D. 浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是 。
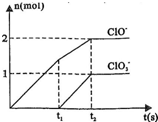 (2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、
(2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、