题目内容
(10分)氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O  HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。
①下列溶液能吸收Cl2的是 (填字母序号)。
| A.饱和食盐水 | B.饱和Na2SO3溶液 |
| C.饱和NaOH溶液 | D.浓硫酸 |
(10分)
(1)2NaCl + 2H2O ="==" 2NaOH + Cl2↑+ H2↑(2分,条件写“通电”或“电解”均可)
解析

 阅读快车系列答案
阅读快车系列答案(11分)氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O  HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)使用氯气为自来水消毒可以有效 地控制次氯酸的浓度,请结合平衡常数解释原因: 。
地控制次氯酸的浓度,请结合平衡常数解释原因: 。
(3)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(4)二氧化氯是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(5)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。
①下列溶液能吸收Cl2的是 (填字母序号)。
| A.饱和食盐水 | B.饱和Na2SO3溶液 |
| C.饱和NaOH溶液 | D.浓硫酸 |
。
③请用原子结构知识解释Cl2的氧化性强于I2的原因:
(10分)氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O  HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。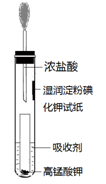
①下列溶液能吸收Cl2的是 (填字母序号)。
| A.饱和食盐水 | B.饱和Na2SO3溶液 |
| C.饱和NaOH溶液 | D.浓硫酸 |
。
(10分)氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O  HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。
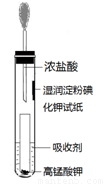
①下列溶液能吸收Cl2的是 (填字母序号)。
A. 饱和食盐水 B. 饱和Na2SO3溶液
C. 饱和NaOH溶液 D. 浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是
。
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸: