题目内容
[化学--选修2化学与技术]二氧化硫在工业制硫酸中有着重要作用,但又是煤燃烧的有害气体.按“循环经济”的模式,就是要将SO2收集起来,把它变为有用的东西.
(1)某空气监测是根据SO2和溴水的定量反应来测定SO2的含量.该反应的化学方程式为 .
(2)若每次取样的空气为200mL,通入足量的溴水中,测得平均有2.408×1018个电子转移,则SO2的含量为 mg?L-1,若规定空气中SO2含量不得超过0.02mg?L-1,则样气是否符合大气的质量标准 (填“符合”或“不符合”).
(3)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O-2e-→SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2+2e-→2Cl-.在上述两个反应中均会生成产物X,则X的化学式为 .
A. NaClO B.NaClO4 C.HClO D.ClO2
(4)在硫酸工业制法中,下列叙述正确的是 .
A.硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B.从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C.SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D.SO3用98.3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提高SO3吸收效率
(5)如表是压强对SO2平衡转化率的影响
对于SO2转化SO3的反应,增大压强可使转化率 (填“增大”、“减少”或“不变”),但在实际工业生产中常采用常压条件,理由是 .
(1)某空气监测是根据SO2和溴水的定量反应来测定SO2的含量.该反应的化学方程式为
(2)若每次取样的空气为200mL,通入足量的溴水中,测得平均有2.408×1018个电子转移,则SO2的含量为
(3)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O-2e-→SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2+2e-→2Cl-.在上述两个反应中均会生成产物X,则X的化学式为
A. NaClO B.NaClO4 C.HClO D.ClO2
(4)在硫酸工业制法中,下列叙述正确的是
A.硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B.从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C.SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D.SO3用98.3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提高SO3吸收效率
(5)如表是压强对SO2平衡转化率的影响
| 压强MPa 转化率% 温度℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
分析:(1)SO2具有还原性,Br2具有氧化性,二者发生氧化还原反应;
(2)根据方程式进行计算;
(3)根据化合价变化规律来分析;
(4)A、依据反应物之间的接触面积越大反应速率越快的原理,送进沸腾炉的矿石要粉碎成细小的矿粒,增大矿石跟空气的接触面积,使之充分燃烧;
B、气体中含有杂质能使催化剂发生中毒;
C、依据催化剂改变反应速率不改变化学平衡;
D、若用水或稀硫酸吸收,轻易形成酸雾,且吸收速度慢;
(5)根据压强对化学平衡的影响;由题目信息可知根时SO2的转化率已经很高,如果增加压强SO2的转化率提高不大,而生产成本增加,得不偿失.
(2)根据方程式进行计算;
(3)根据化合价变化规律来分析;
(4)A、依据反应物之间的接触面积越大反应速率越快的原理,送进沸腾炉的矿石要粉碎成细小的矿粒,增大矿石跟空气的接触面积,使之充分燃烧;
B、气体中含有杂质能使催化剂发生中毒;
C、依据催化剂改变反应速率不改变化学平衡;
D、若用水或稀硫酸吸收,轻易形成酸雾,且吸收速度慢;
(5)根据压强对化学平衡的影响;由题目信息可知根时SO2的转化率已经很高,如果增加压强SO2的转化率提高不大,而生产成本增加,得不偿失.
解答:解:(1)SO2具有还原性,Br2具有氧化性,二者发生氧化还原反应,反应方程式为:SO2+Br2+2H2O=2H2SO4+2HBr,故答案为:SO2+Br2+2H2O=2H2SO4+2HBr;
(2)n(e-)=
mol=4×10-6mol,则n(SO2)=
n(e-)=2×10-6mol,m(SO2)=2×10-6mol×64g/mol=1.28×10-4g,SO2的含量为:
=0.64mg/L,不符合大气的质量标准,
故答案为:0.64;不符合;
(3)向氯酸钠(NaClO3)的酸性水溶液中通入二氧化硫,SO2被氧化,则NaClO3被还原降价,生成物种中Cl氧化态低于NaClO3(+5价);向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,Cl2被还原,则NaClO2被氧化升价,生成物种中Cl氧化态高于NaClO2(+3价)则共同物种Cl氧化态为+4,故选:D;
(4)A、增大反应物浓度、增大反应物间接触面积,能提高反应速率并使化学平衡向正反应方向移动,以充分提高原料利用率,故A错误;
B、气体中含有杂质能使催化剂发生中毒失去活性,不是因为炉气中的SO2会与杂质反应,故B错误;
C、催化剂改变反应速率不改变化学平衡,所以SO2氧化为SO3时需要使用催化剂,这样可以加快其反应速率,不可提高SO2的转化率,故C错误;
D、不能用水吸收三氧化硫而用98.3%的浓硫酸,若用水或稀硫酸吸收,轻易形成酸雾,且吸收速度慢,故D正确;
故选:D;
(5)对于SO2转化SO3的反应,增大压强可使平衡正向移动,转化率增大,此时SO2的转化率已经很高,如果增加压强SO2的转化率提高不大,而生产成本增加,得不偿失,
故答案为:增大;常压下,SO2的转化率已经很高,如果增加压强SO2的转化率提高不大,而生产成本增加,得不偿失.
(2)n(e-)=
| 2.408×10 18 |
| 6.02×10 23 |
| 1 |
| 2 |
| 1.28×10-1mg |
| 0.2L |
故答案为:0.64;不符合;
(3)向氯酸钠(NaClO3)的酸性水溶液中通入二氧化硫,SO2被氧化,则NaClO3被还原降价,生成物种中Cl氧化态低于NaClO3(+5价);向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,Cl2被还原,则NaClO2被氧化升价,生成物种中Cl氧化态高于NaClO2(+3价)则共同物种Cl氧化态为+4,故选:D;
(4)A、增大反应物浓度、增大反应物间接触面积,能提高反应速率并使化学平衡向正反应方向移动,以充分提高原料利用率,故A错误;
B、气体中含有杂质能使催化剂发生中毒失去活性,不是因为炉气中的SO2会与杂质反应,故B错误;
C、催化剂改变反应速率不改变化学平衡,所以SO2氧化为SO3时需要使用催化剂,这样可以加快其反应速率,不可提高SO2的转化率,故C错误;
D、不能用水吸收三氧化硫而用98.3%的浓硫酸,若用水或稀硫酸吸收,轻易形成酸雾,且吸收速度慢,故D正确;
故选:D;
(5)对于SO2转化SO3的反应,增大压强可使平衡正向移动,转化率增大,此时SO2的转化率已经很高,如果增加压强SO2的转化率提高不大,而生产成本增加,得不偿失,
故答案为:增大;常压下,SO2的转化率已经很高,如果增加压强SO2的转化率提高不大,而生产成本增加,得不偿失.
点评:本题主要考查二氧化硫的性质,涉及氧化还原反应、化学反应速率、化学平衡等知识,题目难度中等,注意相关基础知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


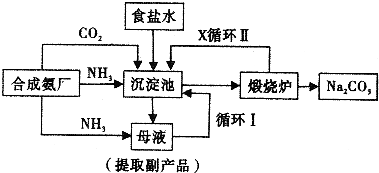
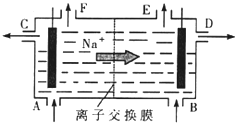 [化学选修2-化学与技术]我国氯碱工业迅速发展,产量已跃居世界首位,并培植了精细化工“产品树”.
[化学选修2-化学与技术]我国氯碱工业迅速发展,产量已跃居世界首位,并培植了精细化工“产品树”.