题目内容
【题目】A、 B、 C、 D、 E、 F 为前四周期元素且原子序数依次增大,其中基态 A 原子的电子分布在 3 个能级,且每个能级所含的电子数相同; C 的原子核外最外层有 6 个运动状态不同的电子; D 是短周期元素中电负性最小的元素; E 的最高价氧化物的水化物酸性最强; 基态 F 原子核外最外层只有一个电子, 其余能层均充满电子。 G 元素与 D 元素同主族,且相差 3 个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是____________________(用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为____________________________。
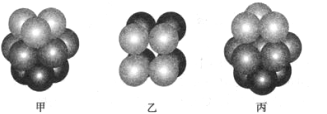
(3)F原子的外围电子排布式为_______________________, F 单质晶体中原子的堆积方式是下图中的_______(填写“甲”、 “乙”或“丙”) ,该晶体的空间利用率为_____________。(保留两位有效数字)
(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________。
(5)通常情况下, D 单质的熔沸点比 G 单质高,原因是_________________________。
(6)已知 DE 晶体的晶胞如下图所示:
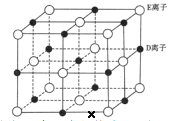
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_________个 A 原子,该晶体的密度是______________g·cm-3(列式表示) 。
【答案】 C sp3 哑铃型 3d104s1 丙 74% 3:4 Na、Cs处于同一主族,并都是金属晶体,同主族元素价电子数相同,从上到下,原子半径依次增大,金属键依次减弱,熔沸点降低 8 ![]()
【解析】基态A原子的电子分布在3个能级,且每个能级所含的电子数相同,即1s22s22p2,则A为C元素,原子序数大于6,最外层有6个运动状态不同的电子,说明C为O元素,所以B为N元素,D是短周期元素中电负性最小的元素,即为Na元素,E的最高价氧化物的水化物酸性最强,即为Cl元素,基态F原子核外最外层只有一个电子,其余能层均充满电子,则其电子排布为[Ar]3d104s1,即29号元素Cu,G元素与Na元素同主族,且相差3个周期,则G为Cs元素。由此分析如下:
(1)同周期元素的第一电离能从左到右一般是依次增大的,但由于N元素最外层是半满状态,所以其电离能大于O元素的,因此C、N、O三种元素的第一电离能由小到大的是C<O<N;
(2)Cl元素形成的HClO4中Cl原子以sp3的杂化方式形成四个共价键,Cl原子占据最高能级为3p能级,其电子云轮廓形状为哑铃型(或纺缍体型);
(3)Cu原子的外围电子排布式为 3d104s1,单质铜的晶体中原子的堆积方式为面心立方,即图丙,这种晶体的空间利用率为74%;
(4)由C、N形成的(CN)2分子的结构简式为NC—CN,其中含有3个σ单键和4个π键,所以 σ键与π键数目之比为3:4;
(5) Na、Cs都属于碱金属元素,最外电子数相同,但从上到下,随电子层数增多,原子半径增大,导致金属键减弱,因此单质的熔沸点降低;
(6)根据题目叙述,该晶胞中的C原子分布在棱的中点、体心和4个“小立方体”的中心,根据原子均滩法可得该晶胞中的C原子数=![]() +1+4=8,其质量为
+1+4=8,其质量为![]() g ,根据A—A单键的键长可求得该晶胞的棱长为
g ,根据A—A单键的键长可求得该晶胞的棱长为![]() cm,体积为
cm,体积为![]() ,所以该晶胞的密度为
,所以该晶胞的密度为![]() g/cm3。
g/cm3。

【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法
(1)用活性炭还原法可以处理氨氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=Q kJ· mol-1。
N2(g)+CO2(g) △H=Q kJ· mol-1。
在T℃时,反应进行到不同时间测得各物质的浓度如下表。
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min 内,NO 的平均反应速率v(NO)=___________。
T1 ℃时,该反应的平衡常数K=___________。
②30min 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母)。___________。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min 后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5∶3 ∶3,则Q________0(填“>”、“=”或“<”)。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图甲所示。
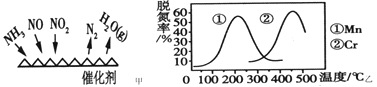
①由图甲可知,SCR技术中的氧化剂为___________。已知c(NO2)∶c(NO)=1∶1时脱氮效果最佳,若生成1mol N2时反应放出的热量为QkJ。此时对应的脱氮反应的热化学方程式为___________。
②图乙是不同催化剂Mn 和Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应的温度分别为________________。